1.3 Stellung des Redoxpaares ( ½ H₂/H⁺ + 1 e⁻) in der Redoxreihe
Siehe Arbeitsblatt zu den Experimenten:
1) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Zinkblech gegeben;
Beobachtung: Es entsteht ein Gas, das Zinkblech "verschwindet" nach einiger Zeit.
Erkläre diese Beobachtung (am besten mit Reaktionsgleichungen)
{slider title="Lösung" open="false" class="icon"}
Gas = Wasserstoff (H₂);
"Verschwinden" = Zink gibt zwei Elektronen ab, wird zu einem Ion und löst sich dann auf (Hydrathülle).
{/sliders}
2) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Fe-Nagel gegeben;
Es entsteht ein Gase, der Eisennagel verschwindet nach einiger Zeit."
{slider title="Lösung" open="false" class="icon"}
Gas = Wasserstoff (H₂);
"Verschwinden" = Eisen gibt zwei Elektronen ab, wird zu einem Ion und löst sich dann auf (Hydrathülle).
{/sliders}
3) zu 10 ml 1 M Salzsäure (H₃O⁺(aq) und Cl⁻ (aq)) wird ein Kupferblech gegeben
Keine Veränderung; Setze das Wasserstoff-Redoxpaar in die richtige Stelle der Redoxreihe.
{slider title="Lösung" open="false" class="icon"}
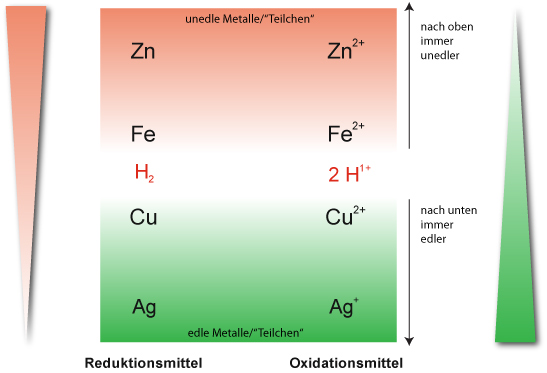
Ergebnis (Redoxreihe): Da die verdünnte Salzsäure nicht mit Kupfer reagiert, steht das Redoxpaar (1/2 H₂ / H⁺+ 1 e⁻) zwischen Eisen und Kupfer.
Merke: Die Metalle, die mit Oxonium-Ionen (Hydronium-Ionen) in einer Redoxreaktion reagieren sind „unedel“.
„Edle“ Metalle (u.a. Kupfer, Silber, Gold) stehen in der Redoxreihe unterhalb diesem Redoxpaar ( ½ H₂/H⁺ + 1 e⁻) und reagieren nicht mit den Oxonium-Ionen unter Wasserstoffbildung.
{/sliders}