2 Elektrochemische (Galvanische) Zellen
Galvanische Zelle = Zelle, die als elektrische Stromquelle dient.
2.1 Daniell-Element
Beim Daniell-Element handelt es sich um eine historisch bedeutsame galvanische Zelle und dient im Schulunterricht häufig als Einstieg zum Thema "Galvanische Zellen". Dieses Element besteht aus einer Zink- und einer Kupferhalbzelle:
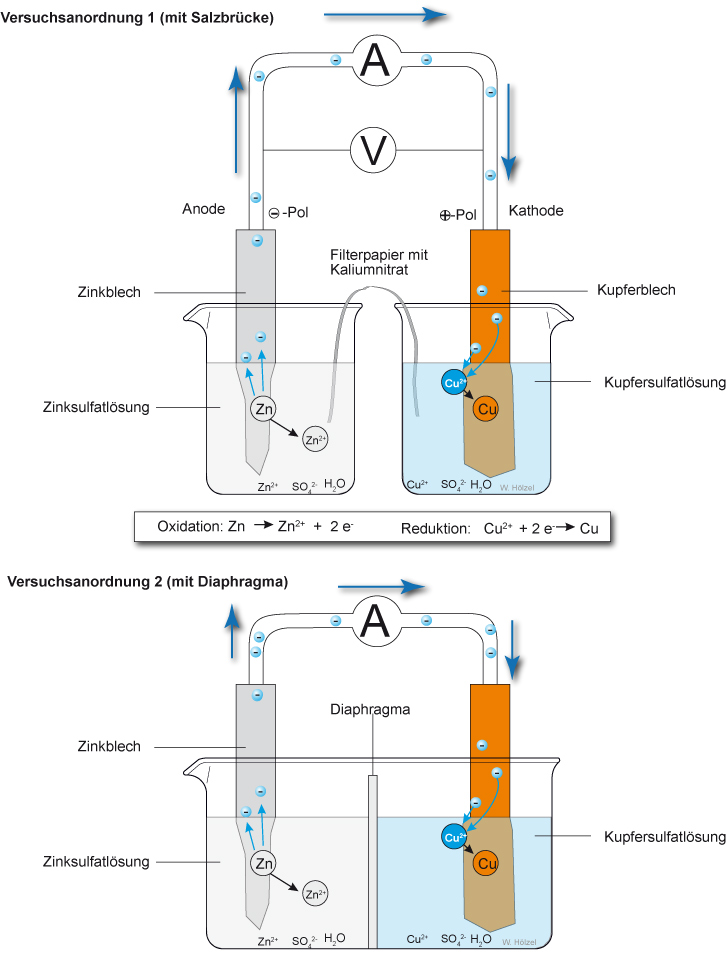
Auswertung des Versuchs:
Im „Außenkreis“ fließen Elektronen (z.B. durch einen Motor oder einem Spannungsmesser/Voltmeter nachgewiesen). Im Becherglas a ging eine bestimmte Stoffmenge Zink in Lösung:
Zn (s) → Zn²⁺(aq) + 2 e⁻
Metallisches Zink löst sich unter Ionenbildung und stellt dabei pro gebildetes Ion 2 Elektronen zur Verfügung.
Im Becherglas b wird eine bestimmte Stoffmenge Kupfer gebildet:
Cu²⁺(aq) + 2 e⁻ → Cu (s)
Zusammenfassung:
Die Elektronen, die durch Lösen des Zinks entstehen, fließen also durch den Draht zum Kupferstab. Dort entladen sie die Cu²⁺-Ionen in der Umgebung des Kupferstabes.
Gesamtreaktion:
Zn (s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu(s)
Oxidation: Zn → Zn²⁺(aq) + 2 e⁻
Reduktion: Cu²⁺(aq) + 2 e⁻ → Cu
--------------------------------------------------------------------------------------
Redox: Zn (s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu (s)
Teilchenglg: Zn (s) + Cu²⁺(aq) + SO₄²⁻(aq) → Zn²⁺(aq) + SO₄²⁻(aq) + Cu (s)
Rktgl mit Verhältnisformeln: Zn (s) + CuSO₄ (aq) → ZnSO₄ (aq) + Cu (s)
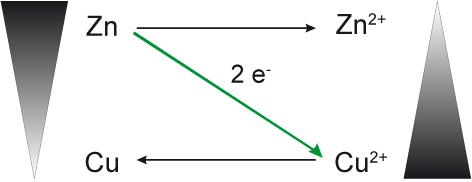
Hinweis: poröse Trennwand verhindert die Vermischung.
Wenn Cu²⁺-Ionen in Kontakt mit der Zink-Elektrode in Kontakt käme, würden die Elektronen direkt übertragen ⇨ kein Stromfluss
Das Daniell-Element mit allen ablaufenden Vorgängen
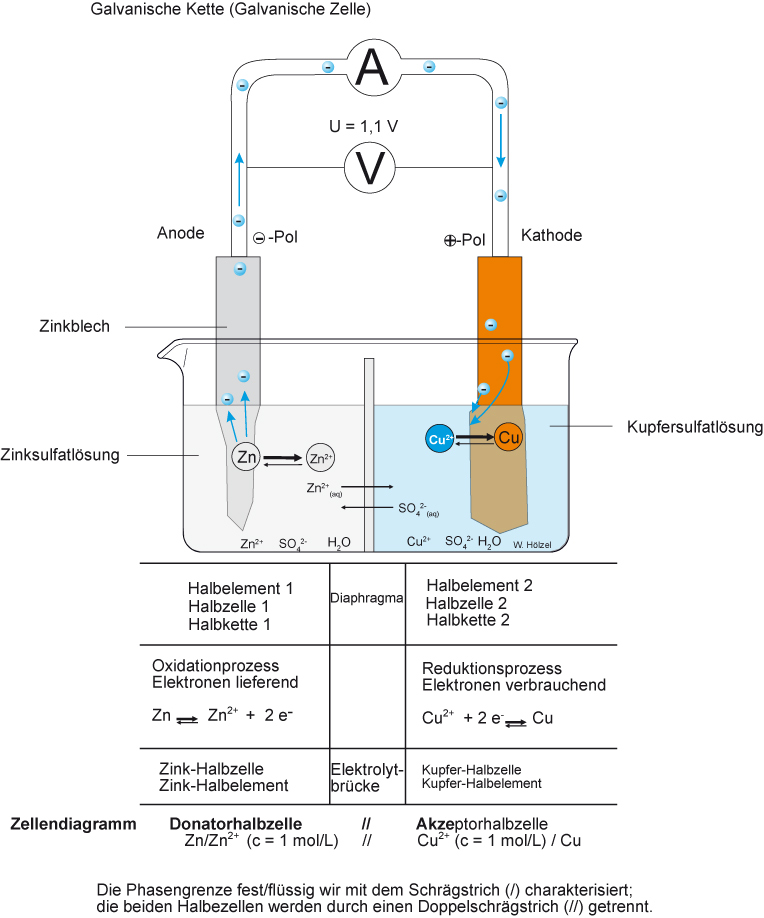
Elektrolyt = Leiter 2. Klasse (leitet den Strom durch Ionenwanderung).
Weitere galvanische Elemente
vgl. dazu Arbeitsblatt und Praktikum. Ergebnis der Spannungsmessung unterschiedlicher galvanischen Elemente kann aus folgender Abbildung entnommen werden:
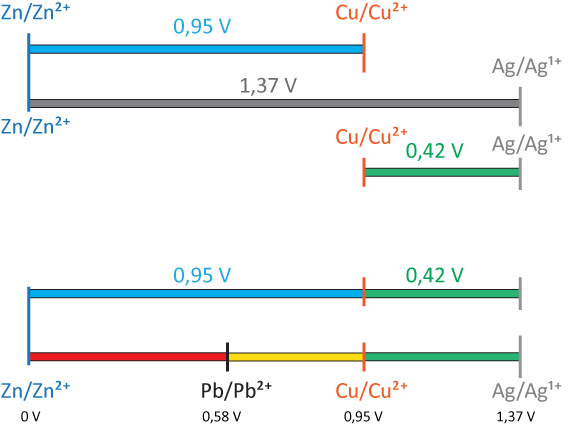
Hier sind unterschiedliche Halbzellen dargestellt. Ganz oben das Daniell-Element (Hinweis: Die Spannungsangaben beruhen auf den Experimenten; sie sind noch keine Standardelektrodenpotentiale). Darunter ein galvanisches Element, welches aus einer Zink- und einer Silberhalbzelle besteht. Das dritte galvanische Element besteht aus einer Kupfer- und einer Silberhalbzelle. Diese Abbildung soll die Zusammenhänge der Halbzellen und den messenden Spannungen erläutern.
