2. Versuch: Kupfer(II)-oxid + Eisen
Kupferoxid ist ein Salz (Ionenverbindung) und besteht aus Cu²⁺-Ionen und O²⁻-Ionen (Oxid-Ionen). Es reagiert bei dieser Reaktion exotherm. Als Produkte erhält man einen rotbräunlichen und einen grauen, porösen Feststoff.
Formuliere dafür die Teilreaktionen und die Redoxreaktion, sowie die Teilchengleichung und ein Redoxschema. Zum Abschluss die Reaktionsgleichung als Stoffgleichung (Summen/Verhältnisformel).
{slider title="Lösung: Eisen und Kupfer(II)-Oxid" open="false" class="icon"}
Teilreaktionen:
Teilchengleichung: Fe + Cu²⁺ O²⁻ → Fe²⁺ O²⁻ + Cu
Redoxschema:
Reaktionsgleichung:
Fe + CuO → FeO + Cu ΔH < 0
Eisen Kupfer(II)-oxid Eisen(II)-oxid Kupfer
Metall, grau Salz, schwarz Salz, Metall,rot-braun
{/sliders}
3. Versuch: Kupferoxid + Zink
Dieser Versuch ist ähnlich zu dem Kupferoxid und Eisen; nur reagiert dieser viel heftiger. Auch hier entsteht ein rötlicher Feststoff. Formuliere hierfür die Teilchgleichung die die Reaktionsgleichung in Verhältnisformeln.
{slider title="Lösung" open="false" class="icon"}
Teilchengleichung: Zn + Cu²⁺ O²⁻ → Zn²⁺ O²⁻ + Cu ΔH < 0
Reaktionsgleichung mit Verhältnisformeln: Zn + CuO → ZnO + Cu ΔH < 0
{/sliders}
4. Versuch: Kupferoxid + Mg
Beim letzten Versuch dieser Reihe lässt man in einer Magnesia-Rinne Kupfer(II)-Oxid und Magnesium reagieren. Diese Reaktion ist noch heftiger (deshalb auch nur die Magnesia-Rinne und nicht in einem Reagenzglas).
Formuliere hierfür:
- Teilgleichungen
- Redox-Reaktionsgleichung aus den Teilgleichung
- Teilchengleichung
- Redoxschema
- Stoffgleichung
{slider title="Lösung" open="false" class="icon"}
Teilgleichungen:
Teilchengleichung:
Mg + Cu²⁺ O²⁻ → Mg²⁺ O²⁻ + Cu
Redoxschema:
Reaktionsgleichung mit Verhältnisformel:
Mg + CuO → MgO + Cu ΔH < 0
Magnesium Kupfer(II)-oxid Magnesium(II)-oxid Kupfer
Metall, grau Salz, schwarz Salz, weiß Metall, rot-braun
{/sliders}
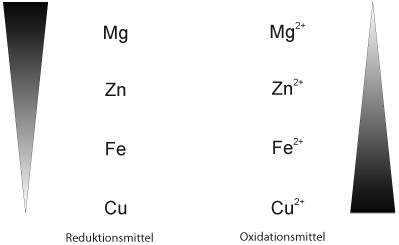
Reduktions- und Oxidationsfähigkeit im Vergleich:
Die Reaktionen verliefen jetzt unterschiedlich heftig. Überlegt Euch, wie man diese "Heftigkeit" innerhalb eines oder mehreren Redoxschemata darstellen kann.
Mögliche Lösung beinhaltet jetzt nicht Magnesium (sorry), dafür Silber.
{slider title="Lösung" open="false" class="icon"}
Zum Üben hier ohne Silber, dafür mit :
{/sliders}





