7 Kalorimetrie
„Nullter“ Hauptsatz der Thermodynamik: 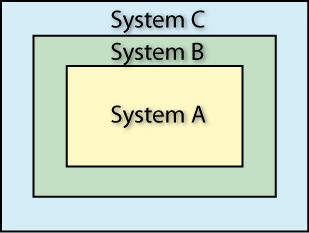 Wenn ein System A sich mit einem System B sowie B sich mit einem System C im thermischen Gleichgewicht befindet, so befindet sich auch A mit C im thermischen Gleichgewicht.
Wenn ein System A sich mit einem System B sowie B sich mit einem System C im thermischen Gleichgewicht befindet, so befindet sich auch A mit C im thermischen Gleichgewicht.
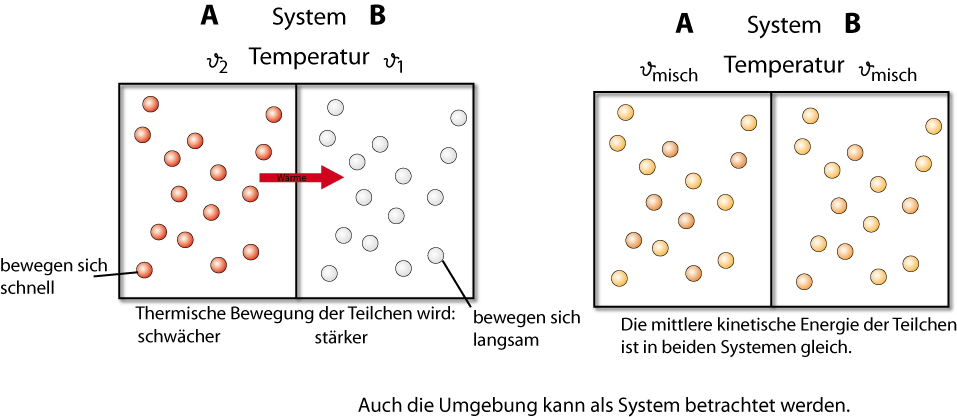
Wärme wird dabei vom System höher Temperatur zum System niedriger Temperatur übertragen.
Bsp: 2 Systeme: System 1 und System 2
Es gilt:
Abgegebene Wärme (Q₁) = entgegengesetzt gleich der aufgenommene Wärme (Q₂)
Bzw: Qab = - Qauf Q₁ = - Q₂
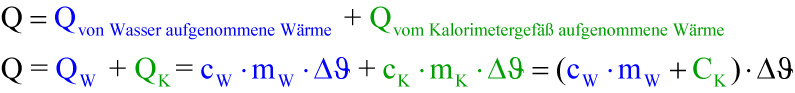
Δϑ = ϑ₂ - ϑ₁ = Temperaturdifferenz
mW = Masse des Wassers
cW = spezifische Wärmekapazität des Wassers (4,1868 J ∙ g⁻¹ ∙ K⁻¹)
CK = Wärmekapazität des Kalorimetergefäßes
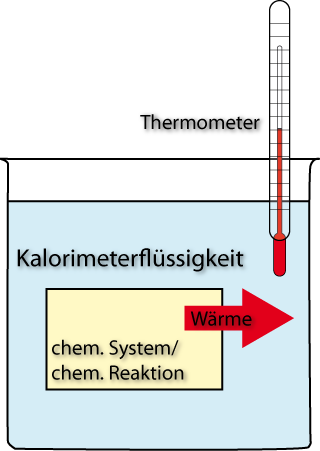
7.1 Bestimmung der Wärmekapazität eines Kalorimeters - Ck
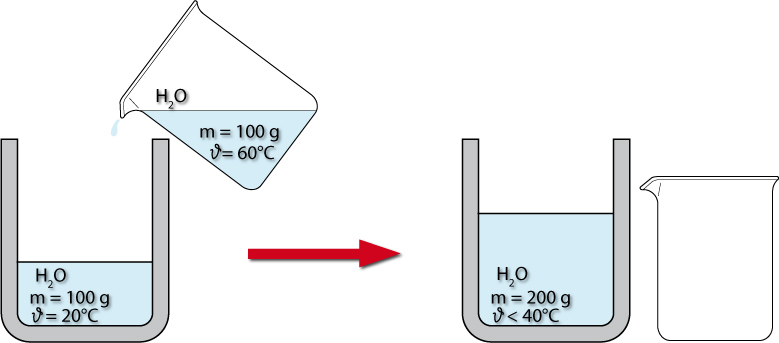
Die restliche Wärme nimmt das Kalorimeter auf.
Δϑ entspricht aufgenommene Wärmemenge
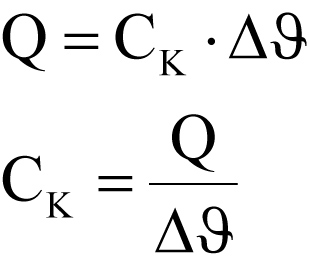
Bestimmung von CK
- Wasser der Masse m₁ und der Temperatur ϑ₁ eingefüllt (damit das Kalorimeter eine bestimmbare Temperatur hat).
- Wasser der Masse m₂ (gleichviel) und der Temperatur ϑ₂ eingefüllt.
- Messung von ϑmisch
Das warme Wasser gibt die Wärme Q₂ ab (Q₂ < 0)
Q₂ = cw ∙ m₂ ∙ (ϑmisch - ϑ₂)
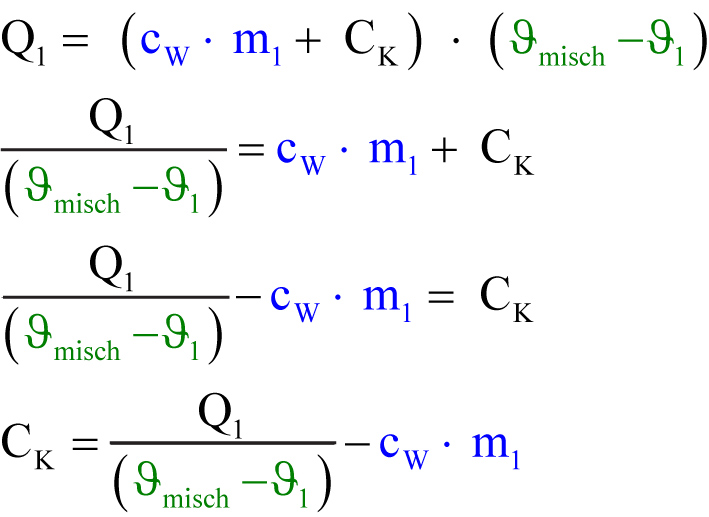
Das kältere Wasser und das Gefäß nehmen Wärme auf:
Q₁ = QW + QK
Q₁ = cW ∙ m₁ ∙ (ϑmisch - ϑ₁) + CK ∙ (ϑmisch - ϑ₁)
Es gilt Qab = - Qauf bzw. Q₁ = - Q₂
Q₁ + Q₂ = 0 (Energieerhaltung)
Q1 einsetzen:
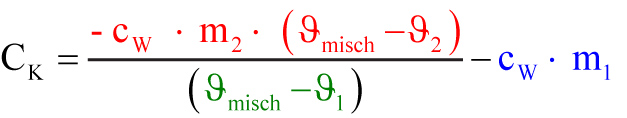
Für die kalorimetr. Bestimmung müssen chem. Reaktionen folgende Voraussetzungen erfüllen:
- schnell ablaufen
- weitgehend vollständig ablaufen
- muss eine ausreichend große Reaktionswärme besitzen
⇨ Veresterung ist ungeeignet
Idealfall: Kein Austausch von Wärme zwischen Kalorimeter und Umgebung. Leider ist das nicht der Fall. Während der Vorperiode und Nachperiode ist die Temperatur nicht konstant. Deshalb findet eine grafische Auswertung statt, wobei man die Temperaturlinien entsprechend verlängert (vgl. Abb).
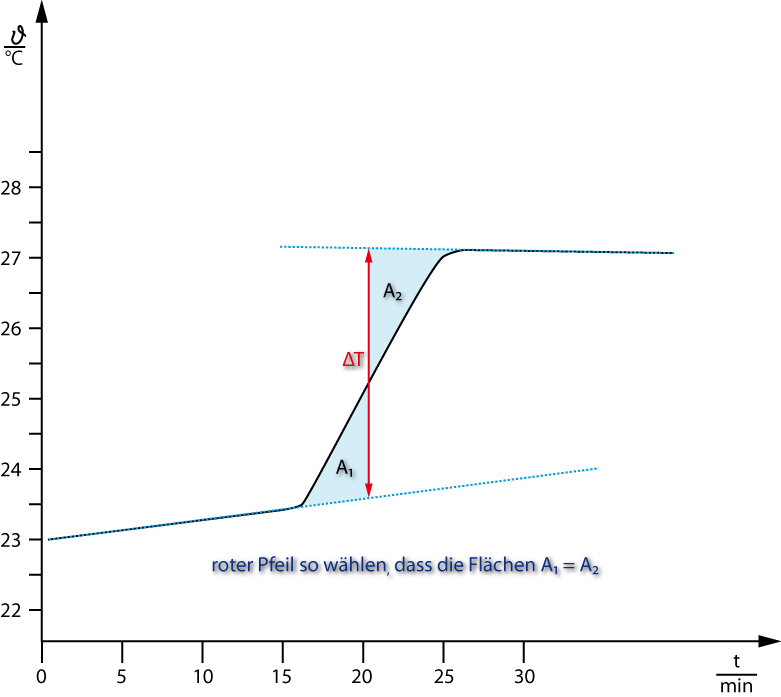
Vorperiode = Zeit vor der chem. Reaktion
Hauptperiode = chem. Reaktion bis zum Endpunkt des Wärmeübergangs
Nachperiode = Zeit, nach beendetem Wärmeübergang
ΔT: wird grafisch bestimmt ⇨ Temperatur-Zeit-Kurven werden verlängert ⇨ senkrechte Linie wird so eingezeichnet, dass die Flächen A1 = A2 sind.
Dewargefäße:
- Doppelte Glaswand (dazwischen evakuiert) ⇨ keine Strömung
- Wärmeabstrahlung wird minimiert durch Verspiegelung
- Kalorimeter: Meist wird Wasser benutzt.