1 Autoprotolyse (Eigenprotolyse) des Wassers und pH-Wert
1.1 Das Ionenprodukt des Wassers
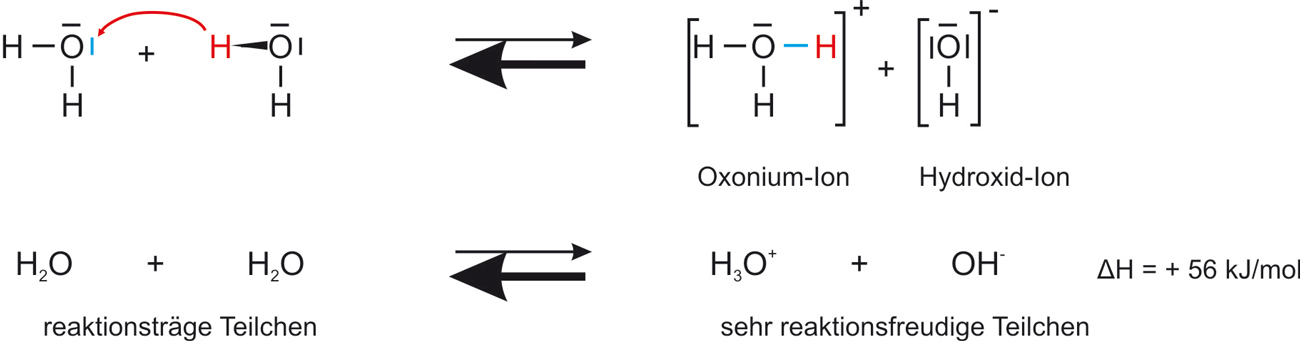
Destilliertes Wasser besitzt eine geringe Leitfähigkeit (Hinweis auf Ionen). Diese Ionen sind durch eine Protolyse-Reaktion entstanden.
Hinweis: Bei der Aufstellung des MWG steht das Oxonium-Ion in der Regel im Zähler.
![]()
Überlegungen:
• 1 mol Wasser hat die Masse 18,0 g
• 1 L (1000 ml) Wasser besitzt bei 25 °C die Masse 997 g;
Wie viel H₂O-Moleküle enthält 1 L Wasser?
Dichte: ![]()
![]()
Stoffmenge:
![]()
![]()
Konzentration:
![]()
![]()
(= 55,4 * 6,022*10²³ Wassermoleküle!)
Die H₂O -Konzentration in Wasser beträgt also 55,4 mol/l.
Z. B. durch Leitfähigkeitsmessung kann die Ionenkonzentration ermittelt werden: Bei 25°C:
![]()
Diese Werte in das MWG einsetzen:
![]()
Kc ist extrem klein, das GG liegt weitgehend auf der linken Seite ⇨ Die Konzentration von H₂O ist daher auch bei GG-Verschiebungen praktisch konstant; sie kann mit der GG-Konstanten K zu einer neuen Konstanten KW (Ionenprodukt des Wassers vereinigt werden)
K • c²(H₂O) = KW = c(H₃O⁺) • c(OH⁻) = 1,00 • 10-14 mol²/l²
Die Konstante KW ist das Ionenprodukt des Wassers:
KW= c(H₃O⁺) • c(OH⁻) = 1,00 • 10-14 mol²/l² bei 25 °C
![]() = c(H₃O⁺) = c(OH⁻) = (1,00 • 10-14 mol²/l²)½ = 1,00 • 10-7 mol/l
= c(H₃O⁺) = c(OH⁻) = (1,00 • 10-14 mol²/l²)½ = 1,00 • 10-7 mol/l
Achtung: In reinem Wasser und in neutralen wässrigen Lösungen beträgt die Konzentration der Hydroxonium-Ionen der der Hydroxid-Ionen: 10-7 mol/l.
Es haben also nur 2 Wasser-Moleküle von einer Milliarde zu einem Oxonium-Ion und eine Hydroxid-Ion reagiert.