3.2 Ammoniak-Gas + Wasser (Springbrunnen 2)
a) Versuch:
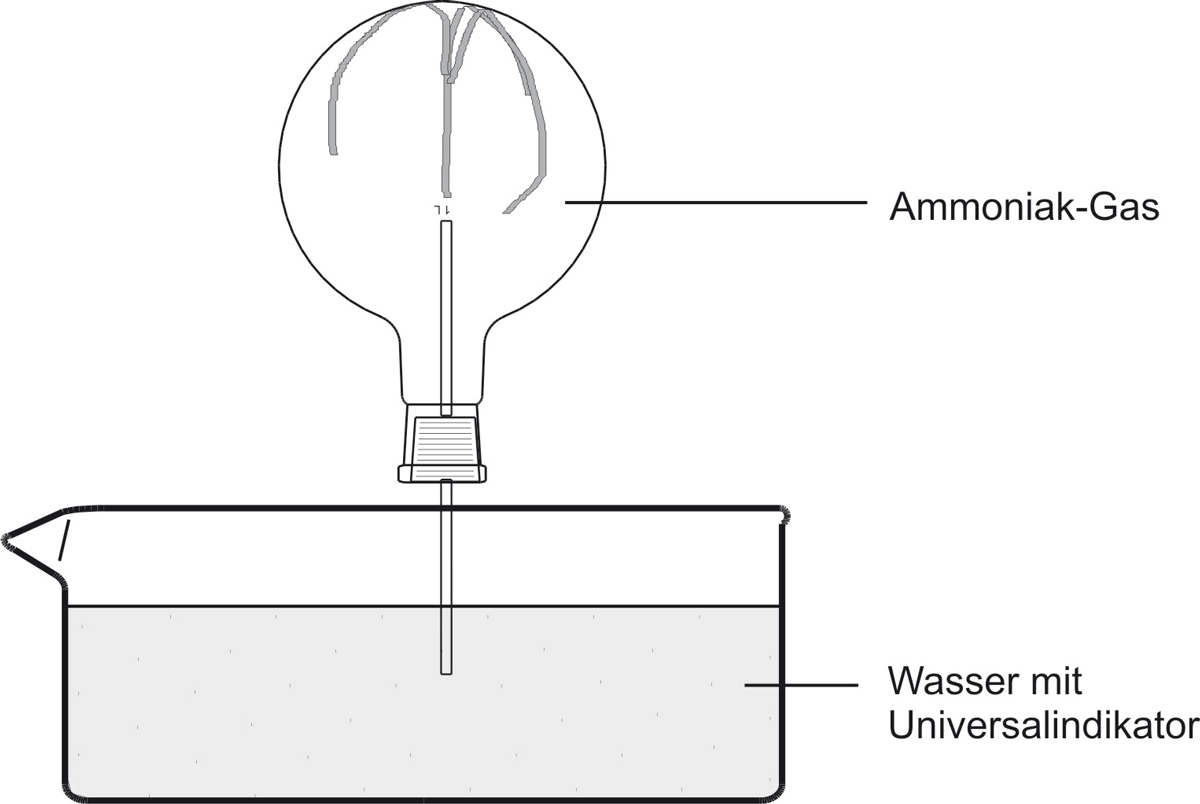
b) Beobachtung:
Das Wasser „schießt“ bergauf in den Rundkolben. Die Indikatorfarbe schlägt nach blau um. Die blaue wässrige Lösung riecht nach Ammoniak.
c) Erklärung:
Ammoniak-Gas löst sich sehr gut im Wasser und reagiert z.T. mit Wasser. Im Zylinder entsteht ein Unterdruck. Die Hydroxid-Ionen färben den Universalindikator blau.
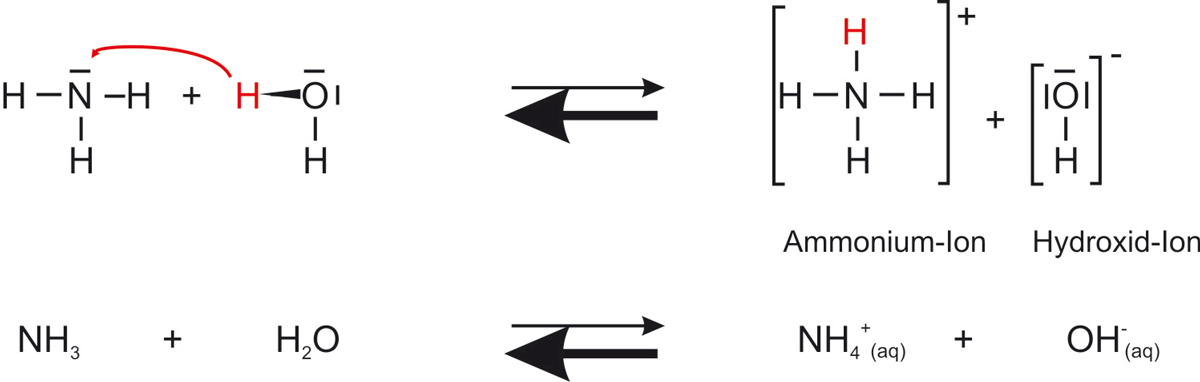
d) Reaktionsgleichung (mit Strukturformeln und Summenformeln)
Versucht diese erst selber zu formulieren!
{slider title="Lösung" open="false" class="icon"}
{/sliders}
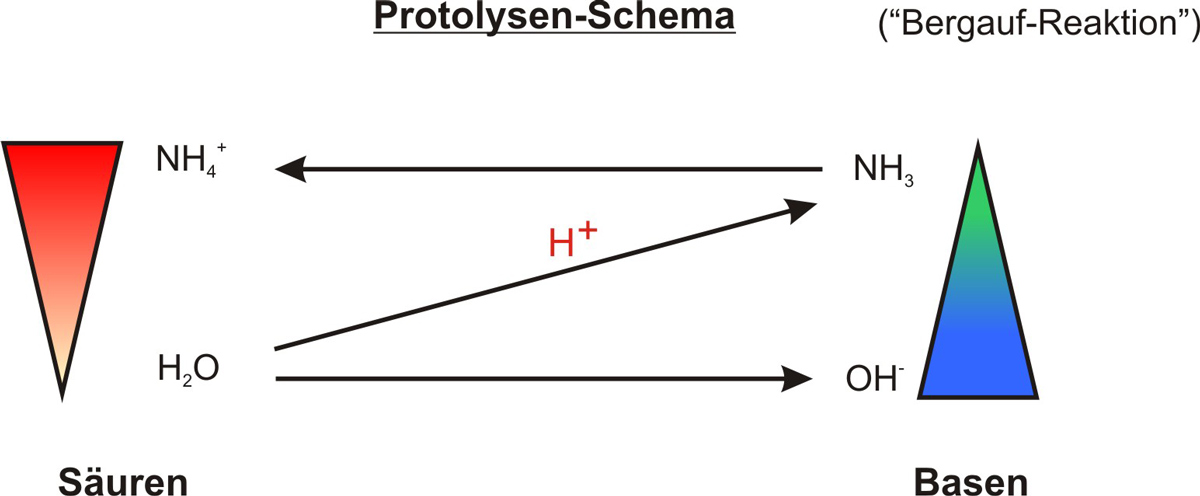
Formuliert das Protolyseschema zu formulieren:
{slider title="Lösung" open="false" class="icon"}
e) Protolyseschema
{/sliders}
Exkurs: Was macht den Sprudel sauer?
Sprudel: CO₂ (g) + H₂O (g) ⇌ “H₂CO₃" (aq) instabil, siehe Erlenmeyer-Regel
1. Protolysestufe: H₂CO₃ (aq) + H₂O (l) ⇌ HCO₃⁻ (aq) + H₃O⁺ (aq)
2. Protolysestufe: HCO₃⁻ (aq) + H₂O (l) ⇌ CO₃²⁻ (aq) + H₃O⁺ (aq)
Nachweis der H₃O⁺-Ionen durch?
a) Geschmack
b) pH-Papier
c) pH-Meter
pH(Sprudel) = 5,1
pH = - lg c(H₃O⁺)
c(H₃O⁺) = 10-pH
= 10-5,1
= 7,9 • 10-6 = 0,0000079 mol/L