5 Reaktionswärme – Q
Bestimmung der Reaktionswärme – Q.
Bsp: Quantitative Umsetzung von Zink (n(Zn) = 1mol, M(Zn) = 65,4 g/mol) anfällt.
Bildung eines gasförmigen Reaktionsproduktes
- bei konstantem Volumen = Hahn geschlossen
- bei konstantem Druck = Hahn geöffnet
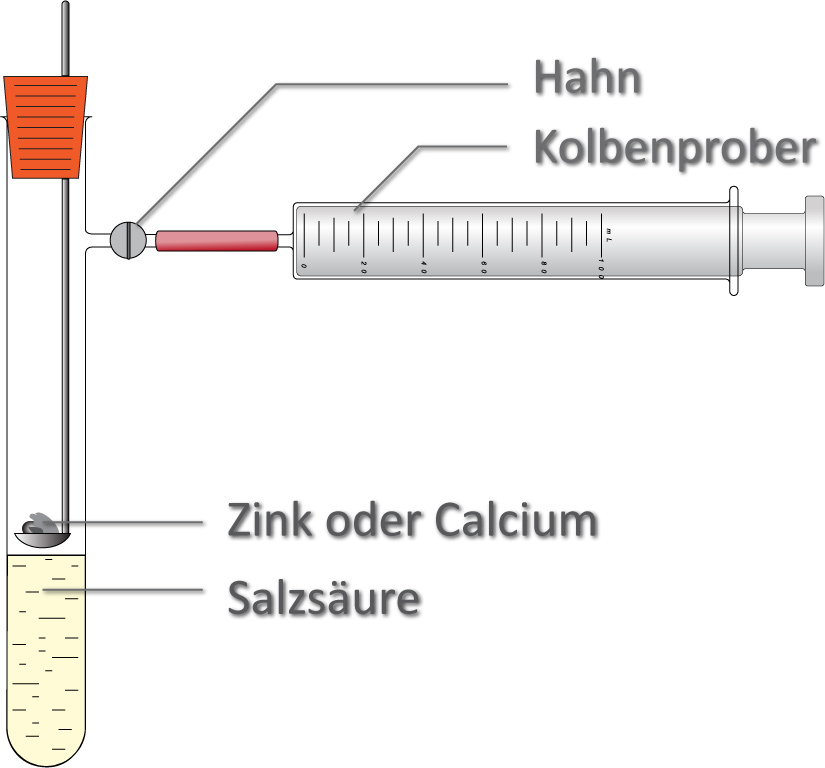
Teilchengleichung:
Zn + 2 H₃O⁺ (aq) + 2 Cl⁻ (aq) → Zn²⁺ (aq) + 2 Cl⁻ (aq) + 2 H₂O + H₂
Freigesetze Reaktionswärme:
bei konstantem Volumen: QV = -156,5 kJ/mol = ΔU
Änderung der Inneren Energie = Reaktionswärme + Volumenarbeit
ΔU = QV + W
ΔU = QV - p ∙ ΔV
QV = Δ U + p ∙ 0
QV = Δ U
bei konstantem Druck: Qp = - 154,0 kJ/mol = ΔH
Bei konstanten Druck gilt:
ΔU = Qp + W
Δ U = Qp – p ∙ Δ V Umstellen nach Q
Qp = Δ U + p ∙ Δ V (= Qp = [U₂ + p ∙ V₂] – [U₁ + p ∙ V₁] )
Enthalpie H ist die spezielle Wärmeenergie bei konstantem Druck
(H von „heat“; Enthalpie: griech: En = darin; thalpos = Wärme)
Definition der Enthalpie: H = U + p ∙ V
→ Qp = H₂ – H₁ = ΔH
Prozessgrößen: Sind vom Weg abhängig (Bsp. Arbeit und Wärme) ⇨ unterschiedliche Werte, je nachdem ob man isobar oder isochor arbeitet.
a) Offene Systeme
- die meisten chemische Reaktionen
- Volumenarbeit
- nicht alles fällt als Wärmeenergie an:
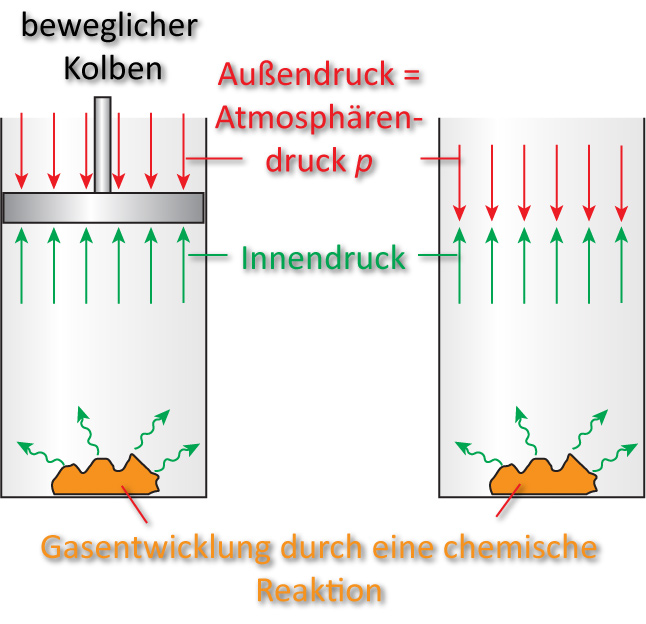
Das entstehende Gas leistet mech. Arbeit gegen den Atmosphärendruck. Die gleiche Arbeit wird auch geleistet, wenn der Kolben fehlt (Außenluft wird verdrängt).
Die Arbeit des Kolbens beträgt: p ∙ Δ V = Volumenarbeit
Änderung Reaktionsenthalpie = Änderung Reaktionsenergie + Volumenarbeit
Δ H = Δ U + p ∙ ΔV
Beispiel:
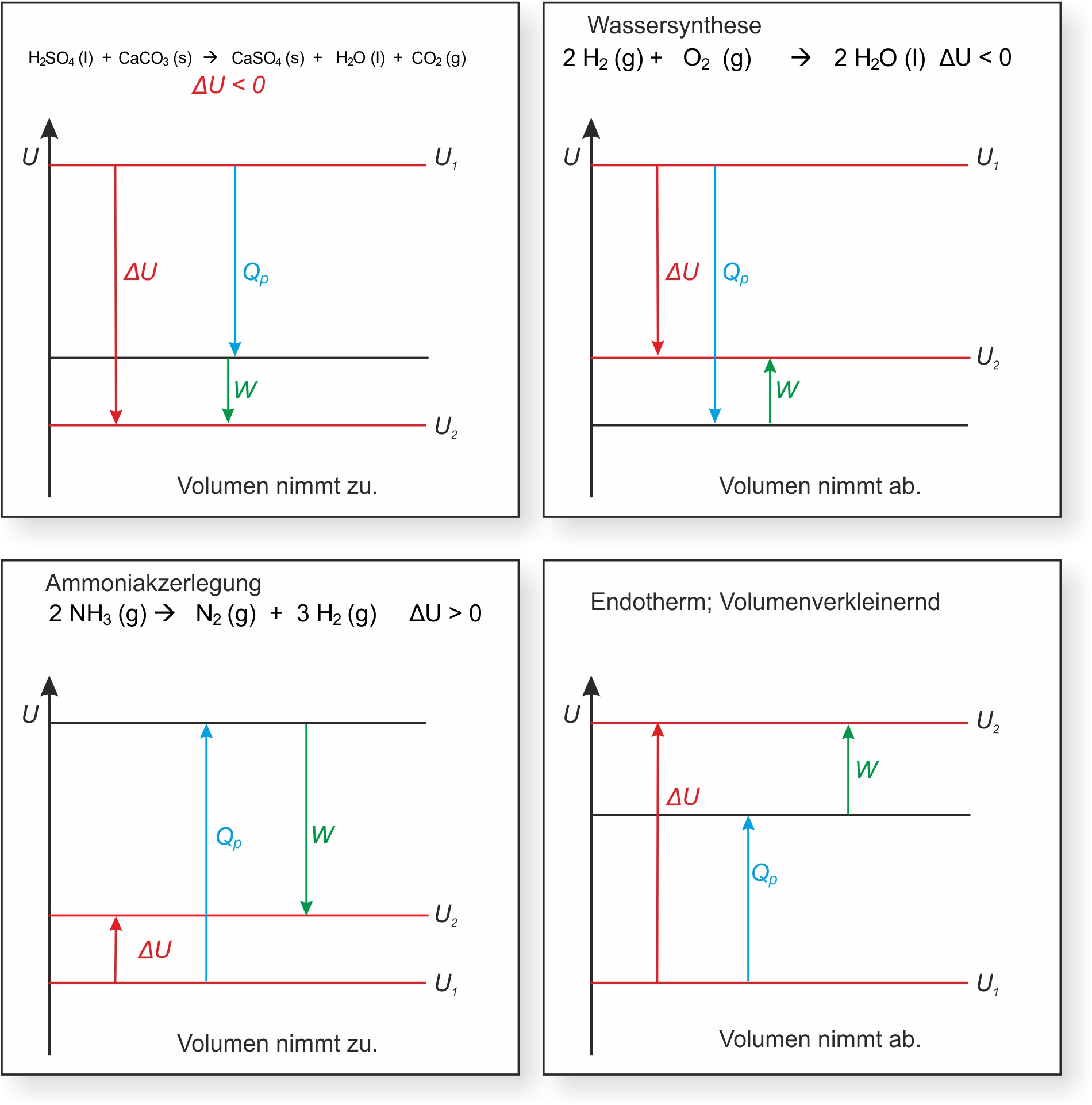
H₂SO₄ (l) + CaCO₃ (s) → CaSO₄ (s) + H₂O (l) + CO₂ (g)
Vm (CO₂) = 24,5 L/mol (bei 25 °C und 101,3 kPa = 101 300 N/m²);
ΔU = - 96,1 kJ/mol
Bei der Reaktion von 1 mol Schwefelsäure:
p ∙ ΔV = 101 ∙ 10³ N/m² ∙ 24,5 ∙ 10-3 m³/mol
= 2,5 ∙ 10³ J/mol ( J = N ∙ m )
= 2,5 kJ/mol
ΔH = Δ U + p ∙ ΔV
= - 96,1 kJ/mol + 2,5 kJ/mol
= - 93,6 kJ/mol
b) Geschlossene Systeme
• keine mechanische Arbeit ⇨ Δ V = 0
• Die bei einer chemischen Reaktion gesamte freigesetzte Energie kann als Wärmeenergie anfallen (Ausnahme: z.B. Lichtenergie)
• Gesamtenergie = Reaktionsenergie ΔU (vgl. oben)
Δ Q = Δ U + p ∙ 0
Δ Q = Δ U
Merke: Die Energiemenge, die ein System bei konstantem Druck als Wärme an die Umgebung abgibt oder von ihr aufnimmt, wird Reaktionsenthalpie ΔH genannt.
Beispiele für chemische Reaktionen mit Volumenarbeit: