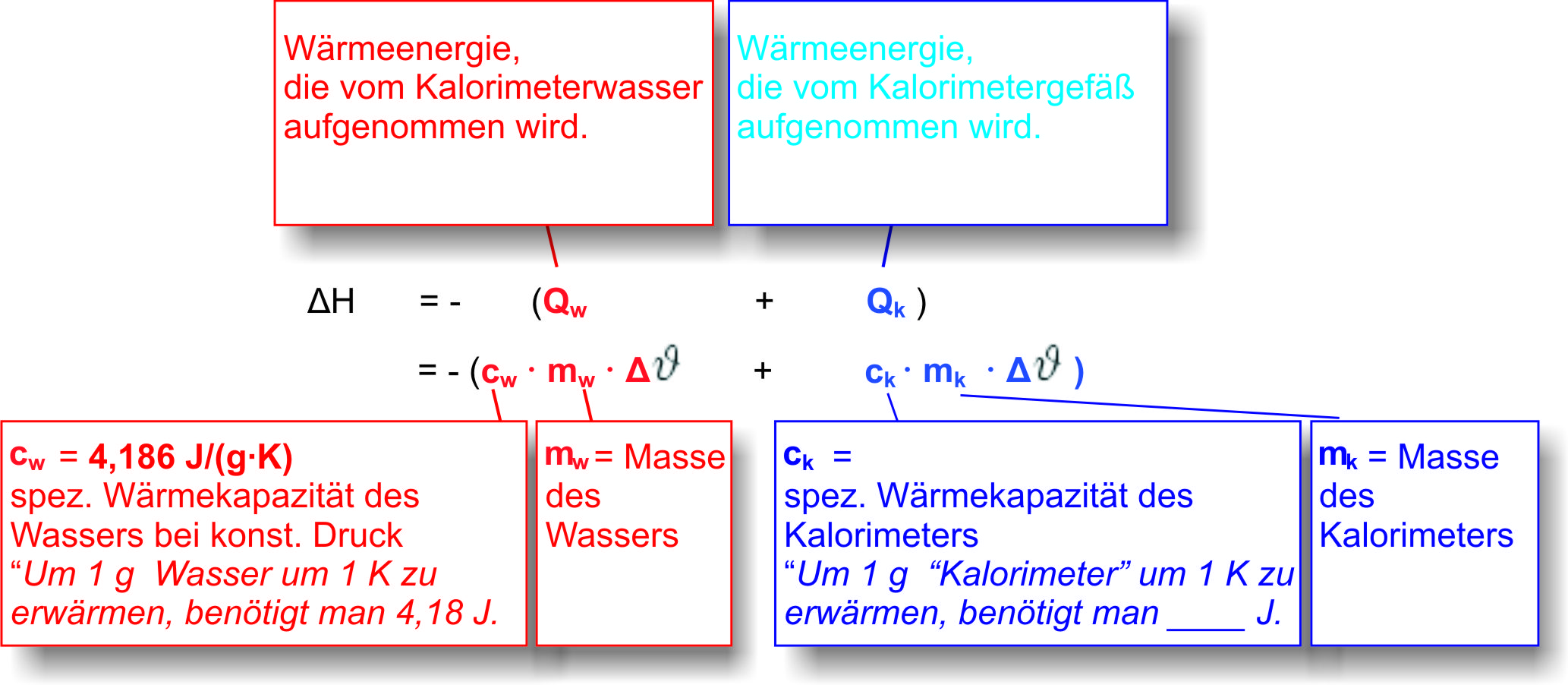
7.2 Bestimmung der Neutralisationsenthalpie
→ vgl. Experiment und Arbeitsblatt:
7.2 Lösungsenthalpien:
vgl. dazu Experimente im Unterricht und Arbeitsblätter
Der beim Lösen beobachtete Temperatureffekt hängt von zwei Faktoren ab:
- der aufzubringenden Gitterenergie: die entgegengesetzt geladene Ionen im Kristall müssen vonei-nander getrennt werden.
- die freiwerdende Hydrationsenergie
Lösungsenthalpie = Gitterenthalpie + Solvationsenthalpie
ΔHsolv = ΔHL + ΔHhyd
Lösungswärme = Gitternergie + Hydrationsenergie
Lösungsenthalpie NaCl in Wasser = (+778 kJ/mol) + (-851+77 kJ/mol) = +4 kJ/mol (25°C).
Kaliumnitrat:
ΔHsolv = 34,9 KJ pro Mol (nach Atkins alles Chemie: +23,8 kJ/mol)
Calciumchlorid:
ΔHsolv = -82,98 kJ/mol (nach Atkins alles Chemie: -81,3 kJ/mol)
Die Lösung erwärmt sich, die Lösungsenthalpie ist daher negativ. Der Literaturwert beträgt -83 kJ/mol.
Natriumhydroxid:
ΔHsolv = nach Atkins alles Chemie: - 44,5 kJ/mol