Zunächst noch ein weiteres Beispiel, nach dem Weg von "Atkins". Im Anschluss werden auch Überlegungen aufgezeigt, wie man den Satz von Hess noch anwenden kann.
5. Standarbildungsenthalpien von Methan

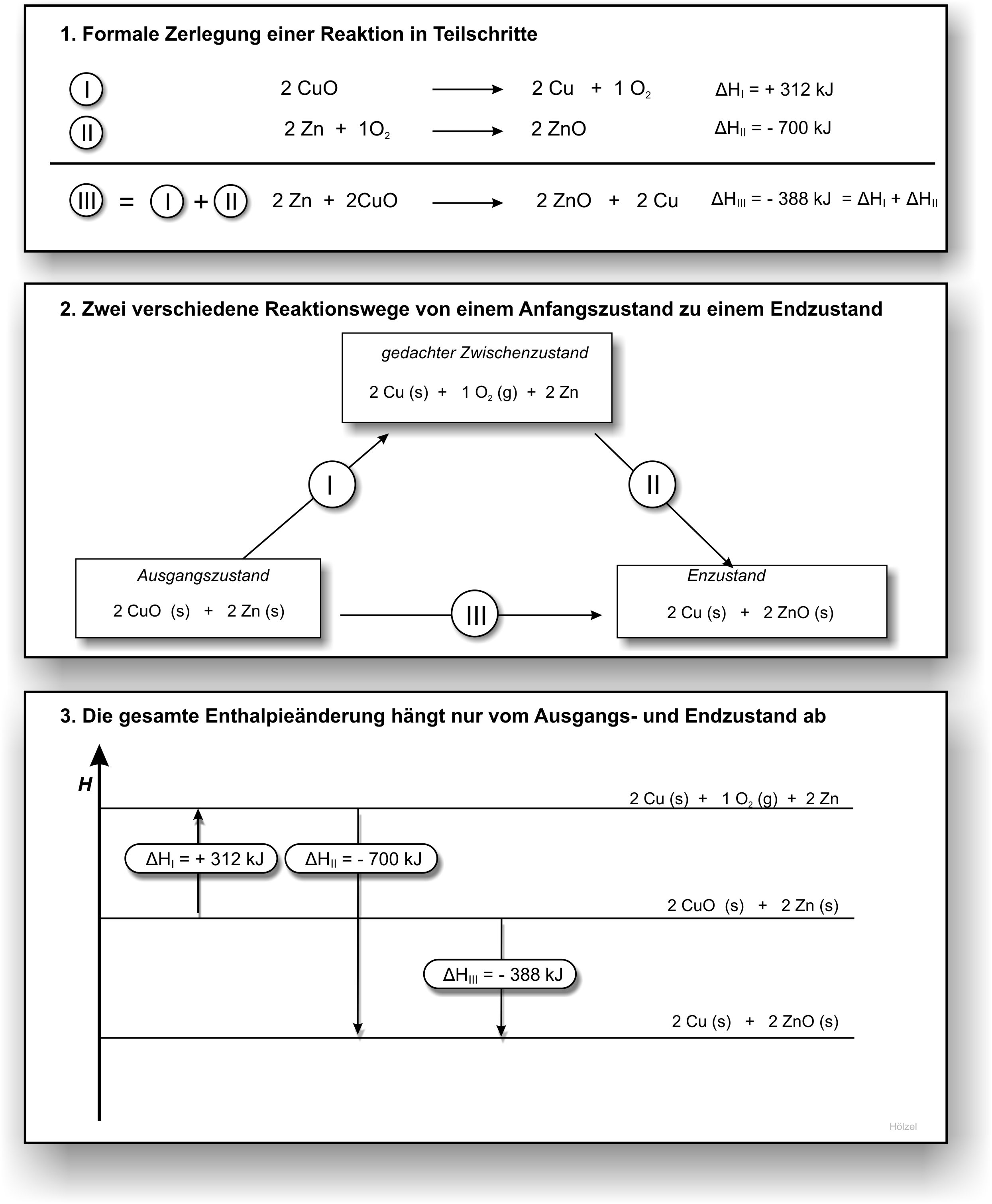
Satz von Hess (Hess'scher Wärmesatz):
Die Enthalpieänderung ΔH eines Gesamtprozesses ist die Summe der Enthalpieänderungen der einzelnen Prozessschritte. Daraus folgt, dass die Reaktionsenthalpie unabhängig vom Reaktionsweg ist. Sie hängt nur vom Anfangs- und vom Endzustand des Systems ab.
1. Berechnung: Reduktion von Kupferoxid mit Zink.
2. Berechnung der Verbrennungsenthalpie (Kohlenstoff zu Kohlenmonoxid)
Die molare Standard-Bildungsenthalpie ΔHf⁰(CO) = ΔHR1⁰ kann experimentell nicht unmittelbar bestimmt werden, da ein Teil von CO zu CO₂ weiter reagiert. Man kann aber experimentell die folgenden molaren Reaktionsenthalpien messen.
Überlegt selbst, wie die Lösung lautet. Die Lösung bekommt ihr, wenn ihr über die Abbildung fahrt.

Nach dem Energieerhaltungssatz ist es egal, ob Graphit zuerst nur bis zum Kohlenmonoxid und dieses dann bis zum Kohlenstoffdioxid weiter reagiert oder ob Graphit zum Kohlenstoffdioxid direkt verbrannt wird.