Grundlagen der Chemie
Chemie zu verstehen ist eigentlich ganz einfach.
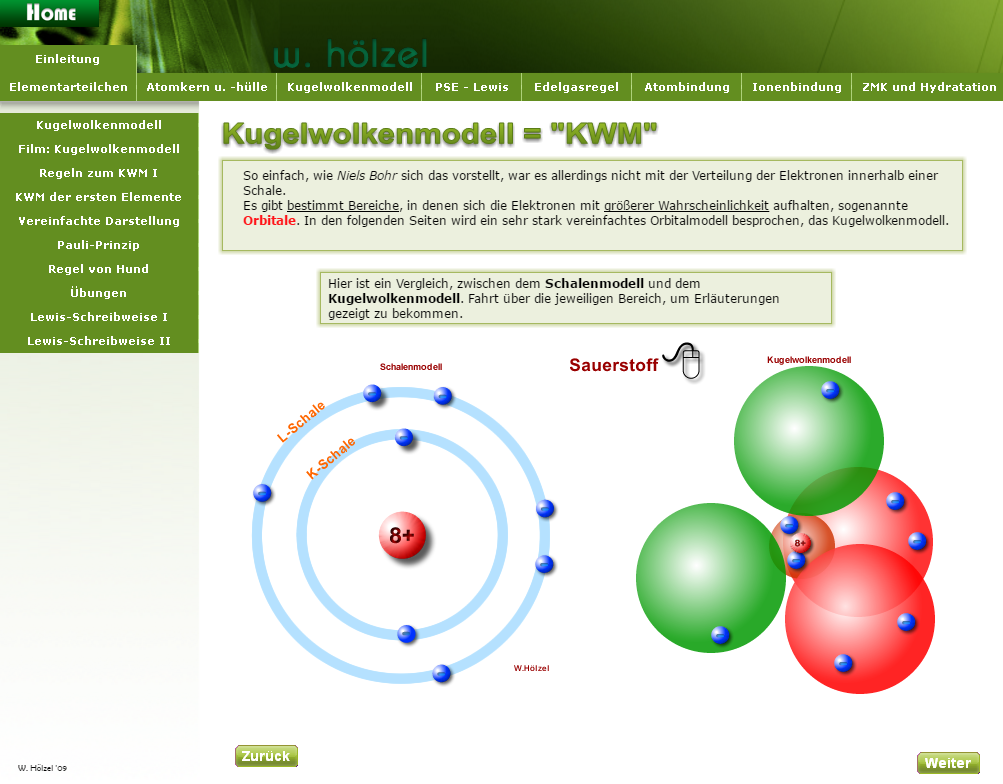
Wenn man sich trotzdem schwer tut, dann fehlen einem wahrscheinlich nur ein paar Grundlagen. Ohne diese Grundlagen ist es weit aus schwieriger, dem Chemie-Unterricht zu folgen. Um diese Grundlagen zu verstehen gibt es hier eine (etwas interaktive) Webseite.
Auf dieser Webseite finden sich auch leichte Übungen. Ziel dieser Einheit ist es auf einfachem Niveau zu verstehen,
- warum Atome Bindungen eingehen;
- Ob eine Molekül- oder eine Ionenbindung vorliegt;
- Welche Ladung Ionen besitzen;
- Was EN bedeutet;
- Ob eine Molekülbindung polar oder unpolar ist;
- Wie viele Bindungen ein Atom eingehen kann;
- Wie das Periodensystem der Elemente (PSE) aufgebaut ist.
