2 Alkene
2.1 Ethen
2.1.1 Eigenschaften
- farbloses, brennbares Gas;
- die Flamme leuchtet stärker als bei Methan und Ethan;
- Siedetemperatur: -104°C
- Schmelztemperatur: - 169°C
2.1.2 Ermittlung der Summenformel
a) Qualitative Analyse (Verbrennungsanalyse)
Bei der vollständigen Verbrennung von Ethen entstehen H2O und CO2.
b) Quantitative Analyse (Bestimmung der molaren Masse)
Die molare Masse von Ethen: M(Ethen) = 28 g/mol
Die Molekülmasse von Ethen: 28 u
c) Summenformel (Molekülformel): C2H4
2.1.3 Strukturformel
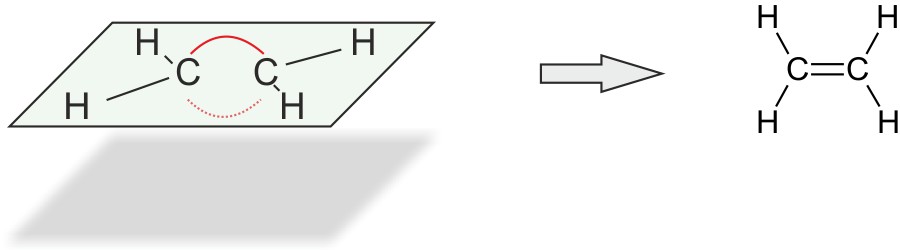
Die Doppelbindung zwischen den beiden C-Atomen wird durch zwei Elektronenpaare gebildet. Diese stoßen sich ab. Man spricht von einer „Bogenbindung“ („Bananenbindung“).
Im Ethen Molekül betragen die Bindungswinkel 120°.
Alle Atome liegen in einer Ebene.
Die C=C-Doppelbindung verhindert die freie Drehbarkeit um die C-C-Achse.
Aufgabe: Wie viel Liter Luft benötigt man bei der Verbrennung von 2 l Ethen
{slider title="Lösung" open="false" class="icon"}
C2H4 + 3 O2 → 2 CO2 + 2 H2O
1 Molekül 3 Moleküle 2 Moleküle 2 Moleküle
Stoffmenge n: 1mol 3 mol 2 mol 2 mol
Mol. Volumen V 22,4 L 67,2 L 44,8 L
Dreisatz: x/2L = 67,7L/22,4L
Zur Vollständigen Verbrennung von 2 L Ethen benötigt man 6 L Sauerstoff, d.h. 30 L Luft.
{/sliders}
.
2.1.4 Vorkommen, Gewinnung und Verwendung
a) Vorkommen
Bei Pflanzen als Hormon (Phytohormon). Steuert:
- Fruchtreifung
- Keimwachstum
- Entwicklung
- Dickenwachstum
- Blattfall
- Informationsweitergabe an benachbarte Pflanzen
b) Gewinnung
- Cracken von Erdöl
c) Verwendung
- Reifung von Früchten
- Herstellung von organischen Stoffen (Kunststoffe, Tenside, ...)