3 Elektrolyse
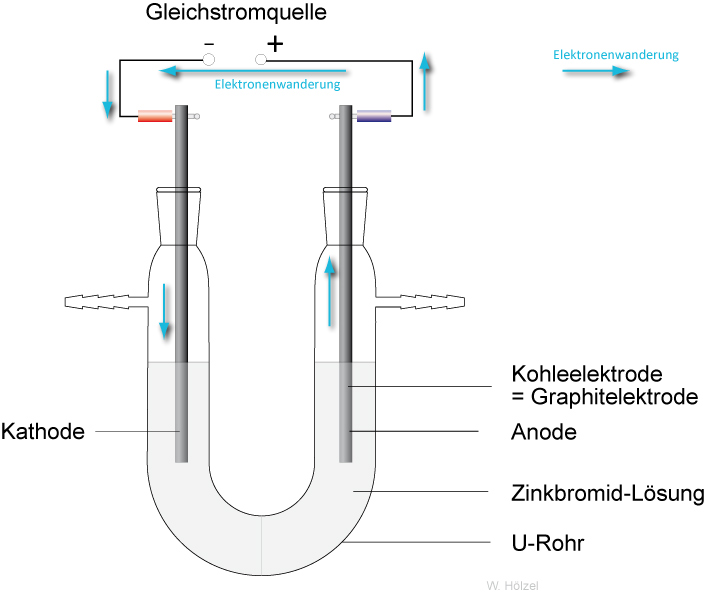
3.1 Elektrolyse einer Zinkbromid-Lösung (oder Zinkiodid)
Beobachtung:
an der Kathode (--Pol) bildet sich Bart aus Zink
an der Anode bilden sich gelbe Schlieren.
Auswertung:
Formuliert hierfür die Oxidation, die Reduktion und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Anode (+ Pol): 2 Br¹⁻ → Br₂ + 2 e⁻ [Hier werden Elektronen "entzogen"]
Kathode (- Pol): Zn²⁺ + 2 e⁻ → Zn [Hier werden Elektronen "reingepumpt"]
Gesamt: ZnBr₂ → Zn²⁺ + 2 Br¹⁻ → Zn + Br₂
{/sliders}
Zur Herstellung der Elemente aus dem Salz muss Energie aufgewendet werden; die Reaktion wird erzwungen.
Zusammenfassung: Bei der Elektrolyse einer Zinkbromid-Lösung entsteht Zink und Brom. Die Vorgänge bei der Elektrolyse laufen nicht freiwillig ab. Es sind erzwungene Redox-Reaktionen
(ΔH > 0; ΔH positiv)
Mann kann nach der Unterbrechung der Elektrolyse eine Spannung zwischen den Elektroden fest-stellen; verbindet man die Elektroden, so kann man einen Elektromotor betreiben.
Durch die Elektrolyse ist eine galvanische Zelle (galvanische Kette) entstanden:
Formuliere das Zellendiagramm der galvanischen Zelle:
{slider title="Lösung" open="false" class="icon"}
Donatorhalbzelle Zn / Zn²⁺ //½ Br₂[C] / Br¹⁻ Akzeptorhalbzelle
{/sliders}
In der galvanischen Zelle laufen folgende Halbzellenreaktionen ab:
Oxidation: Anode (-Pol): Zn → Zn²⁺ + 2 e⁻
Reduktion: Kathode (+Pol): Br₂ + 2 e⁻ → 2 Br¹⁻
Galv. Zellenreaktion: Zn + Br₂ → Zn²⁺ + 2 Br¹⁻
Die Zellenreaktion (Redoxreaktion) läuft spontan (freiwillig) ab.
Die Elektrolysereaktion ist somit die Umkehrung der in der galvanischen Zelle freiwillig ablaufenden Zellenreaktion.
Gegenüberstellung Galvanische Zelle – Elektrolyse
| Kathode | Anode | |
| angezogene Ionen | Kationen | Anionen |
| Richtung des Elektronenflusses | in die Zelle | aus der Zelle |
| Halbreaktionen | Reduktion | Oxidation |
| Pole: | ||
| bei Elektrolyse (Ladevorgang) | - | + |
| bei galvanischer Zelle (Entladung) | + | - |
| Galvanische Zelle | Elektrolyse | |
| Ablaufende Vorgänge |
Redoxreaktion ist Ursache einer elektrischen Spannung |
Redoxreaktion wird durch Anlegung einer elektrischen Spannung erzwungen |
| Minuspol | An der Anode: Oxidation | Kathode: Reduktion |
| Pluspol | Kathode: Reduktion | Anode: Oxidation |
| Spannung | Differenz der Elektrodenpotentiale | Differenz der Abscheidungspotentiale |
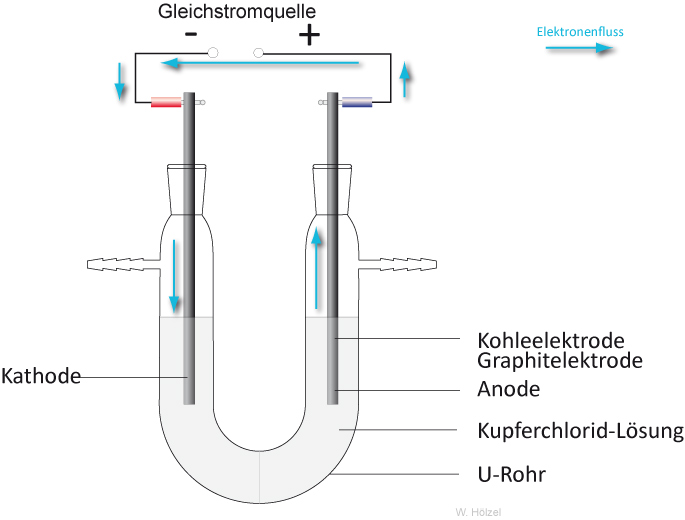
3.2 Elektrolyse einer Kupfer(II)-chloridlösung
a) Versuchsaufbau:
Die Gleichstromquelle wirkt wie eine Elektronenpumpe: Sie saugt Elektronen von der Anode (Plus-Pol) ab und drückt sie in die Kathode (Minus-Pol).
b) Beobachtung (Gleichstromquelle eingeschaltet):
am Plus-Pol (Anode) entsteht ein stechend riechendes, grüngelbes Gas;
am Minus-Pol (Kathode) entsteht ein rot-brauner Feststoff.
c) Auswertung
Die beweglichen Cu²⁺-Ionen werden vom Minus-Pol und die beweglichen Cl⁻-Ionen werden vom Plus-Pol angezogen.
Formuliert die Vorgänge an den Graphit-Elektroden:
{slider title="Lösung" open="false" class="icon"}
Kathodenreaktion (Reduktion): Cu²⁺ + 2 e⁻ → Cu
Anodenreaktion (Oxidation) 2 Cl⁻ → Cl₂ + 2 e⁻
Teilchengleichung: Cu²⁺ + 2 Cl¹⁻ → Cu + Cl₂
{/sliders}