2.5.2 Anwendung der Spannungsreihe
In der Spannungsreihe sind die Standard-Elektrodenpotentiale der Redoxpaare Me/Men+ so angeordnet, dass oben das Redoxpaar Li/Li+ mit dem negativsten Standardpotential (Normalpotential) steht.
A) Mögliche Voraussagen 1: Mit der Spannungsreihe kann man Voraussagen von möglichen Redoxreaktionen in wässrigen Lösungen machen.
Dabei gilt:
Eine Halbzelle überträgt Elektronen nur auf solche Halbzellen, die in der elektrochemischen Spannungsreihe tiefer stehen.
Anders ausgedrückt:
Eine Reaktion tritt nur ein, wenn das oben stehende Metall (das Reduktionsmittel) elementar, d.h. oxidierbar, das unten stehende Metall in der Ionenform (als reduzierbar) vorliegt.
Merke: Kurz als „Berg-ab“-Regel:
In der Spannungsreihe werden Elektronen „bergab“ übertragen.
Beispiele:
- Kupferblech in Silbernitratlösung; es läuft eine Redoxreaktion ab, Ag scheidet sich ab.

- Kupferblech in Zinksulfatlösung; es findet keine Redoxreaktion statt („Berg-auf-Reaktion!).
- Welche Metalle lösen sich in verdünnten Säuren?
Welche Metallhalbzellen reduzieren Hydroxonium-Ionen zu elementarem Wasserstoff und bilden dabei aus Metallatomen Metallionen?
a) Eisennagel in verdünnte Salzsäure; es findet eine Redoxreaktion statt. Hinweis: Das Standardpotential von Fe -> Fe²⁺ ist - 0,41 V!
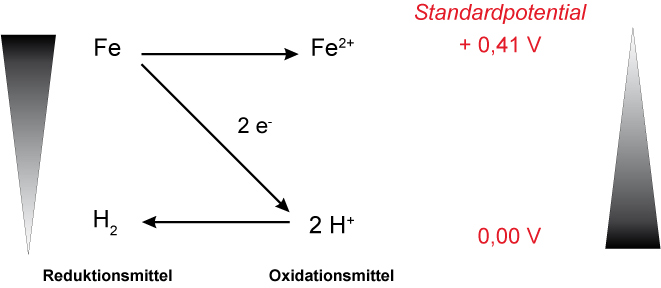
b) Kupferblech in verdünnte Salzsäure; es findet keine Redoxreaktion statt. („Berg-auf“-Reaktion).
Merke: Elektronen werden unter Standardbedingungen von denjenigen Halbzellen auf H₃O⁺-Ionen übertragen, die in der Spannungsreihe oberhalb der NHE-Halbzellen stehen; d.h H₃O⁺-Ionen können nur die Metalle zu Metallionen oxidieren, die oberhalb der Wasserstoff-Halbzelle stehen.
B) Voraussage 2: Welcher Pol bei einer galvanischen Zelle positiv (Kathode) und welcher Pol negativ (Anode) ist.
C) Voraussage 3: Welche Zellspannung (Klemmspannung) eine galvanischen Zelle hat.
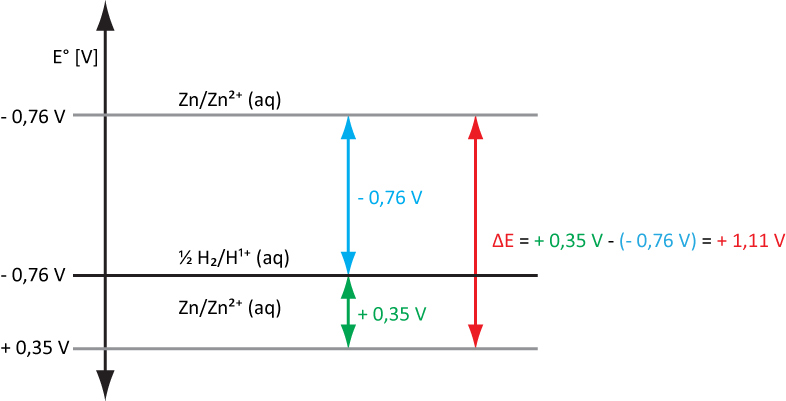
Bsp.: Daniell-Element: Zn/Zn²⁺(c = 1 mol/L)//Cu²⁺(c = 1 mol/L)/Cu
ΔE = E° (Kathode; Akzeptorhalbzelle) – E° (Anode; Donatorhalbzelle)
ΔE = + 0,35 V – (-0,76 V) = 1,11 V
Gedächtnisstütze:
Je positiver das Redoxpotential ist, desto größer ist die Tendenz der oxidierten Form des Redoxpaares (negative!) Elektronen anzuziehen. [Aus dem Anfängerunterricht 8. Klasse: Unterschiedliche Ladungen (+ und -) ziehen sich an]
Je negativer das Redoxpotential ist, desto größer ist die Tendenz der reduzierten Form, Elektronen abzugeben. [Aus 8. Klasse: Gleiche Ladungen stoßen sich ab.]
