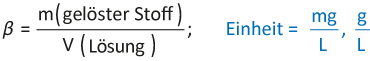7 Konzentration
In diesem Kapitel geht es um die Grundlage der Berechnung von Stoffmengenkonzentrationen. Da das Thema parallel mit dem Schulbuch bearbeitet wird gibt es hier nur die wichtigsten Formeln.
Falls du dich überhaupt nicht mehr daran erinnern kannst, was Molare Masse, Stoffmenge, etc. ist, empfehle ich entsprechende Kapitel im Schulbuch oder die folgenden Kapitel auf dieser Seite durchzulesen: 4. Quantitative Beziehungen
Wiederholung:
| Größe | Symbol | "Definition" | Einheit | Beispiel |
| Masse | m | g (kg, t, mg) |
z.B. m(HCl) = 2 g | |
| Stoffmenge | n | mol | n(HCl) = 2,33 mol | |
| Molare Masse | M | |
M(HCl) = 36,46 g/mol [bezieht sich auf den Stoff und steht im PSE!] |
|
| Volumen | V | l, cm³ | V(HCl) = 1 l | |
| Molares Volumen | Vm | |
Wichtig: Das Volumen von Gasen pro Mol (also bei gleicher Anzahl der Teilchen) ist annähernd konstant. Deshalb ist es auch wichtig, die Zahlenwerte auswendig zu lernen. Vm(Gas) = 22,4 L/mol (bei 0°C) |
Problem: Angaben der Stoffmenge eines Stoffes in einer Lösung. Zum Beispiel wie viele Oxonium-Ionen befinden sich ein einem Becherglas mit zusätzlichen Wassermolekülen:
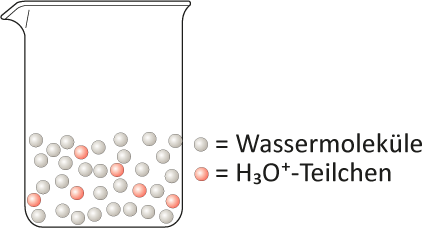
Angenommen, ich habe 1 mol (ihr wisst vielleicht noch, dass 1 mol extrem viele Teilchen sind. Mol steht für 6,022 * 10²³ Teilchen) Oxonium-Ionen in einem Liter Wasser gelösts. Schütte ich nun exakt 0,5 L dieser Lösung in ein zweites Becherglas, dann habe ich nur noch je 0,5 mol Oxonium-Ionen in jedem Becherglas. Das heißt die Anzahl der Oxonium-Teilchen hat sich in jedem Becherglas halbiert. Aber die Konzentration ist trotzdem gleich geblieben: Die Lösung ist noch immer genau so sauer. Und genau das möchte ich mit Hilfe von Gehaltsangaben verdeutlichen:
Gehaltsangaben:
a) Massenanteil
b) Massenkonzentration
c) Stoffmengenkonzentration
Das ist die wichtigste Gehaltsangabe in der Schulchemie. Wenn in der Schule von Konzentration gesprochen wird, meint man die Stoffmengenkonzentration.
Übungen:
Im weiteren werden wir vor allem mit der Formel der Molaren Masse (M = m/n) und der Stoffmengenkonzentration ( c = n/V(gesamt)) arbeiten:
1. Aufgabe:
10 g Natriumhydroxid (NaOH) werden in Wasser gelöst und die Lösung mit Wasser auf 500 ml aufgefüllt. Bestimme die Stoffmengenkonzentration c der Natronlauge (=Natriumhydroxid in Wasser gelöst). [Erg.: c(NaOH(aq)) = 0,5 L/mol]
{slider title="Tipp" open="false" class="icon"}
Lösungsschritte:
geg.: M(NaOH) ⇒ steht im PSE, m(NaOH) = 10g, V = 0,5 L, M = m/n und c = n/V
ges.: c (NaOH(aq))
1. Berechne M mit Hilfe der Werte im PSE
2. Berechne n durch Umstellung der Formel M = m/n <=> n = m/M
3. Berechne c durch Einsetzen von n (aus 2.) und V (siehe geg).
{/sliders}
{slider title="Lösung" open="false" class="icon"}
M(NaOH) = (23+16+1) g/mol = 40 g/mol
n(NAOH) = m(NaOH)/M(NaOH)= 10g/40g/mol = 0,25 mol
c(NaOH) = n(NaOH)/V(Lösung) = 0,5 mol/l
{/sliders}
2. Aufgabe:
Berechne die Konzentration einer Kaliumnitratlösung (KNO₃). Für diese Lösung wurde 10 g Kaliumnitratlösung in 5 Liter Wasser gelöst.
{slider title="Tipp" open="false" class="icon"}
Lösungsschritte:
geg.: M(KNO₃) ⇒ steht im PSE, m(KNO₃) = 10 g, V = 5 L, M = m/n und c = n/V
ges.: c (KNO₃(aq))
1. Berechne M mit Hilfe der Werte im PSE
2. Berechne n durch Umstellung der Formel M = m/n <=> __________
3. Berechne c durch Einsetzen von n (aus 2.) und V (siehe geg).
{/sliders}
{slider title="Lösung" open="false" class="icon"}
M(KNO₃) = (39+14+3⋅16) g/mol = 101 g/mol
n(KNO₃) = m(KNO₃)/M(NKNO₃)= 10g/101g/mol = 0,1 mol (0,99010 mol)
c(KNO₃) = n(KNO₃)/V(Lösung) = 0,02 mol/l (Danke an A.W. für die Korrektur)
{/sliders}
3. Aufgabe:
Berechne die Masse an Kaliumhydroxid, die Du für die Herstellung von Kalilauge mit einer Stoffmengenkonzentration von 1 mol/L benötigst. Kalilauge ist Kaliumhydroxid in Wasser gelöst.
{slider title="Tipp" open="false" class="icon"}
Lösungsschritte:
geg.: M(KOH) ⇒ steht im PSE, c(KOH (aq)) = 1 mol/L, V = 1 L, M = m/n und c = n/V
ges.: m (KOH)
1. Berechne n mit Hilfe Formel für Stoffmengenkonzentration (ist so einfach, dass man es vielleicht auch sofort "sieht").
2. Berechne m durch Umstellung der Formel M = m/n <=> __________
{/sliders}
{slider title="Lösung" open="false" class="icon"}
n(KOH) = c(KOH) ⋅ V(Lösung) = 1 mol/L ⋅ 1 L = 1 mol
M(KOH) = (39+16+1) g/mol = 56 g/mol
m(KOH) = n(KOH) ⋅ M(KOH)= 1mol ⋅ 56 g/mol = 56 g
{/sliders}