5.2 Peptide
5.2.1 Herstellung
Aus Aminosäuren (exakt: Aminosäurederivaten) lassen sich Ketten- und ringförmige Peptide herstellen (zuerst E. Fischer 1903).
Schematisch (zwei gleiche Aminosäuren, z.B. Glycin)
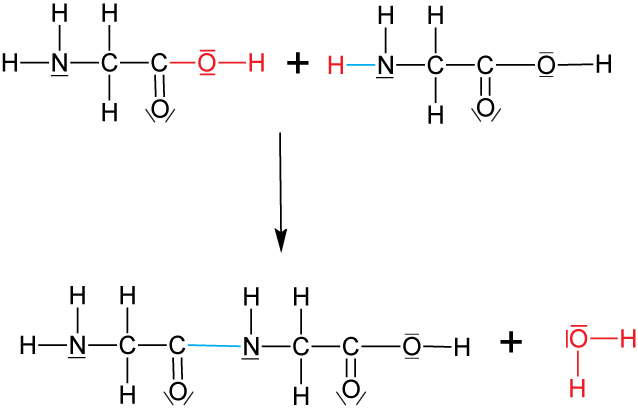
Dipeptid
Typische Kondensationsreaktion
5.2.2 Funktionelle Gruppe
Peptid-Gruppe (Säureamid-Gruppe)

(Buch: -CO-NH-)
analog der Ester-Gruppe
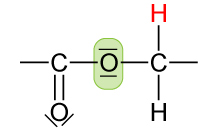
- keine freie Drehbarkeit der C-N-Bindung.
- C-N-Abstand ist kleiner als bei C-N-Bindung in Aminen (132 pm < 147 pm)
- alle Atome der Peptidgruppe liegen in einer Ebene
⇨ Mesomerie mit 2 mesomeren Grenzformeln
cis-trans-Isomerie
Peptide liegen immer als trans-Konfiguration vor;
Starrheit der Peptidmoleküle.
5.2.3 Glutathion (GSH, ein Tripeptid)
Aufgabe: Welche Aminosäuren erhält man durch Hydrolyse (erhitzen mit Säuren oder Alkalien) und anschließende chromatographische Trennung?
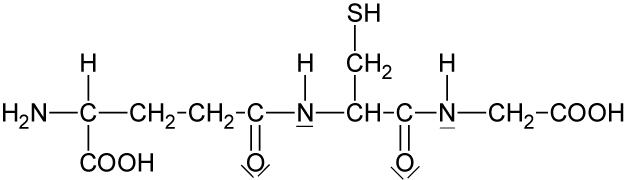
Lösung:

- Glutaminsäure
![]()
- Cystein
![]()
- Glycin
![]()
Vorkommen: in fast allen tierischen und pflanzlichen Zellen
Funktion: wirkt als Wasserstoffüberträger bei biochemischen Oxidations- und Reduktionsvorgängen
