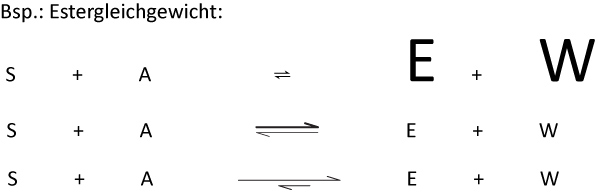
2.6 Schreib- und Sprechweise bei Gleichgewichtsreaktionen
Man sagt: „Das GG liegt rechts“
Um zu zeigen, dass das Gleichgewicht rechts liegt, gibt es mehrere Möglichkeiten:
- Man kann die Produkte "größer" Schreiben (wird so gut wie nie benutzt);
- Man kann den Pfeil nach rechts dicker machen;
- Man kann den Pfeil nach rechts länger zeichen.
2.7 Estergleichgewicht und Kollisionsmodell
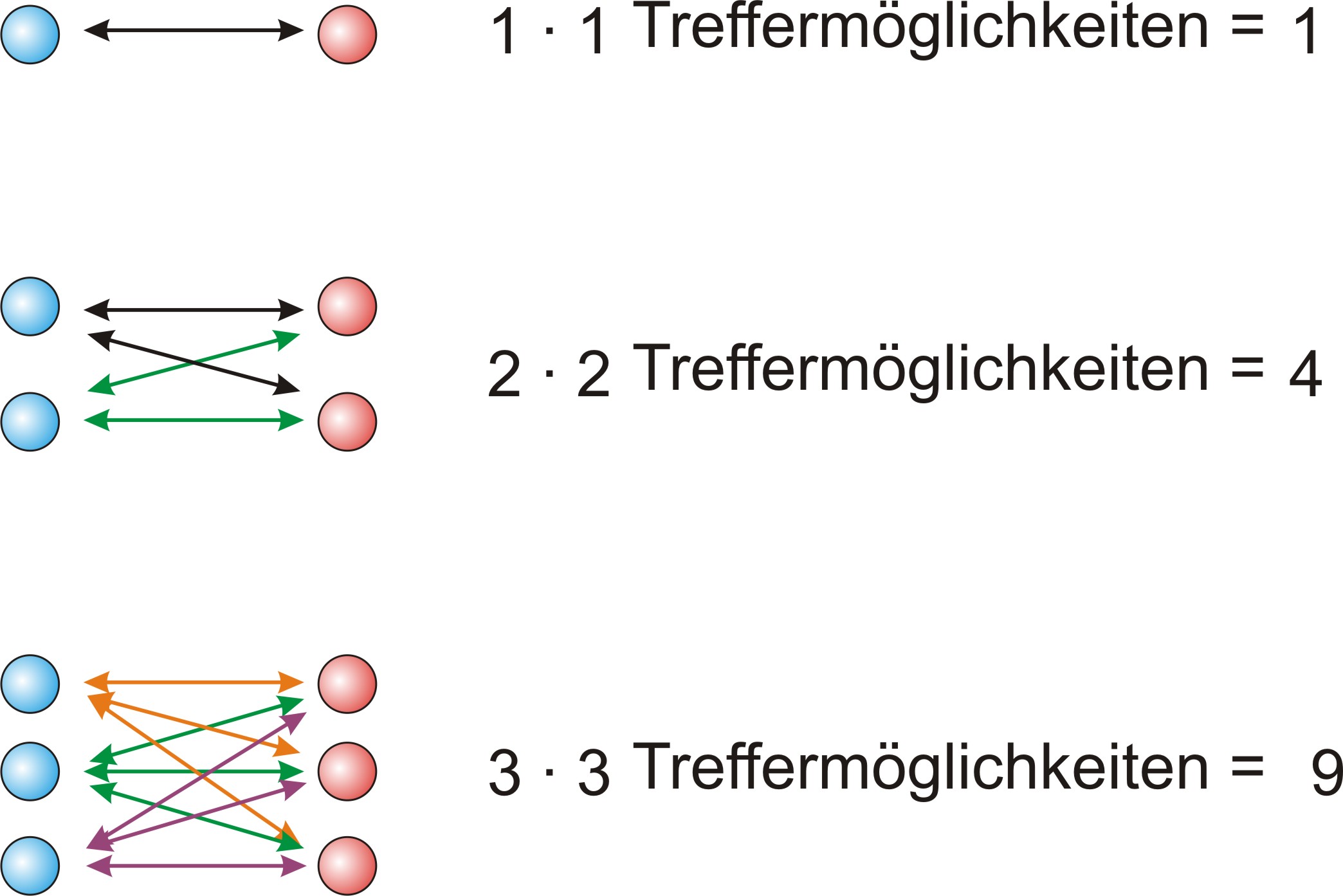
Problem: Wie ist ein Gleichgewicht zwischen wenigen Säure- und Alkoholmolekülen und vielen Ester- und Wasserteilchen möglich?
2.7.1 WH: Kollisionsmodell
{slider title="Wiederholung" open="false" class="icon"}
Damit Teilchen miteinander reagieren können, müssen sie zusammenstoßen.
a) Erklärung: Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit:
Reaktionsgeschwindigkeit bei Stoffen zweier Phasen (Aggregatzustände):
- Können nur an der Phasengrenze miteinander reagieren
- Je größer die Oberfläche (je stärker der Zerteilungsgrad), desto höher die Reaktionsgeschwindigkeit ⇨ Anzünden eines Feuers
⇨ Biologie: Oberflächenvergrößerung/-verkleinerung
b) Mindestgeschwindigkeit der Teilchen = Temperaturabhängigkeit
- nicht jeder Zusammenstoß führt zur Reaktion
- Reaktion setzt eine Mindestenergie und die richtige Orientierung der Teilchen zueinander voraus.
höhere Temperatur => höhere mittlere Geschwindigkeit der Teilchen
Mindestgeschwindigkeit vA ist nötig
Maxwell-Boltzmann-Verteilung bei 3 Temperaturen:
vgl. Heftaufschrieb.
Je höher die Temp, desto mehr Teilchen überschreiten eine gegebene Temp. vA.
RGT-Regel (Reaktions-Geschwindigkeit-Temperaturregel):
Bei vielen Reaktionen bewirkt eine Temperaturerhöhung um 10°C eine 2-4 fache Beschleunigung der Reaktionsgeschwindigkeit.
Zusammenfassung: 3 Faktoren die die Reaktionsgeschwindigkeit beeinflussen:
- Konzentration
- Temperatur
- Sterische Faktoren (v.a. bei großen Molekülen)
Info: Arrhenius-Gleichung beschreibt die quantitative Abhängigkeit der Reaktionsgeschwindigkeitskonstante k von der Temperatur
![]()
k = Geschwindigkeitskonstante
A = sterischer Faktor (Produkt aus der Stoßzahl Z und dem Orientierungsfaktor P)
EA = Aktivierungsenergie
R = 8,314 J/(K mol); Avogadro-Konstante (NA) und Boltzmann-Konstante (kB) R = NA ∙ kB
T = absolute (thermodynamische) Temperatur (Einheit: K).
e = Konstante = eulersche Zahl = 2,72
⇨T groß ⇨ k groß ⇨ v groß
⇨EA klein ⇨k groß ⇨v groß
{/sliders}
Zurück zum Problem: Wie ist ein Gleichgewicht zwischen wenigen Säure- und Alkoholmolekülen und vielen Ester- und Wasserteilchen möglich?
Wie ist ein Gleichgewicht zwischen wenigen Säure- und Alkoholmolekülen und vielen Ester- und Wasserteilchen möglich?
S + A ⇌ E + W
| Weniger Stöße, jedoch größere Erfolgchancen: Teilchen sind reaktionsfreudig | Viele Stöße, jedoch geringere Erfolgschancen Teilchen sind reaktionsträge |
Merke: Wenige reaktionsfreudige Teilchen können vielen reaktionsträgen Teilchen das Gleichgewicht halten.
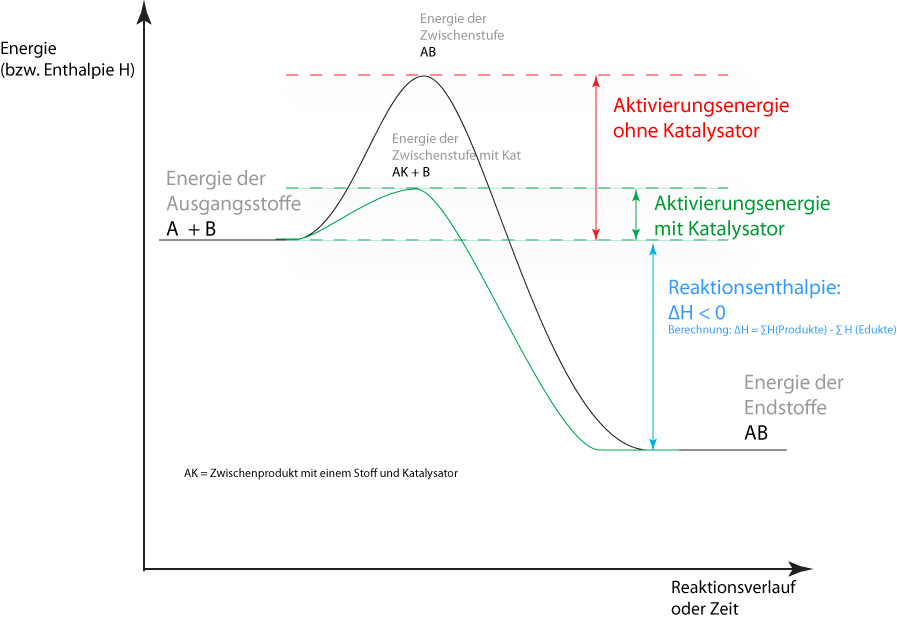
2.7.2 Reaktionsgeschwindigkeit und Katalysatoren
a) homogene Katalyse: Edukte und Kat. sind in der gleichen Phase (z.B. Lsg)
- Bildung von Zwischenstufen ⇨ EA ↓ ⇨ vmin ↓
b) heterogene Katalyse: Edukte u. Kat bilden 2 verschiedene Phasen
Edukte werden an Kat.-Oberfläche adsorbiert
⇨ Schwächung der Bdg.
⇨ günstige Räumliche Orientierung
⇨ Erhöhung der Konzentration
(Bsp. H₂ an Pt-Oberfläche)
Vermutung: Elektronenüberschuss oder –mangel an Oberfläche.
c) Autokatalyse: Katalysator entsteht erst durch den Reaktionsablauf ⇨ Reaktion erst langsam ⇨ dann immer schneller (vgl. Abb. S. 80)
d) Biokatalyse: Enzyme (Proteine, Eiweiße) beschleunigen sehr selektiv Reaktionen ⇨ Bilden Enzym-Substrat-Komplex ⇨ Rkt findet bei Körpertemperatur statt. Substratspezifisch und Wirkungsspezifisch;