4 Stärke von Säuren und Basen: KS und KB-Werte
4.1 Säurestärke: der pKS-Wert
Als Maß für die Stärke einer Säure dient das Ausmaß ihrer Reaktion mit Wasser.
Allgemeines Beispiel:
HA + H₂O ⇌ A¹⁻ + H₃O⁺ 
Wie beim Ionenprodukt des Wassers kann man die Konzentration des Wassers als konstant ansehen und mit der Konstanten K zusammenfassen. ![]()
KS ist die Säurekonstante (Säuredissoziations¹konstante).
Ist der Zahlenwert von KS sehr groß, so handelt es sich um eine sehr starke Säure.
Folgende Säuren protolysieren in Wasser fast vollständig:
- Perchlorsäure HClO₄
- Jodwasserstoff HI
- Chlorwasserstoff HCl
- Schwefelsäure H₂SO₄
⇨ Bei diesen Säuren kann man eigentlich keine KS-Werte angeben: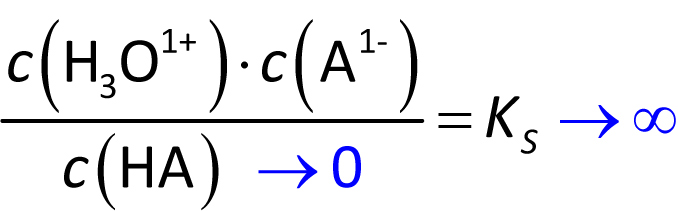
Da die KS-Werte von schwachen Säuren sehr klein sind, kann man die Stärke von Säuren auch durch den pKS-Werte angeben:
pKS = -lg KS
Es gilt: ![]()
Merke: Je kleiner der pKS-Wert, umso größer ist die Stärke einer Säure.
Sehr starke Säuren: pKS < - 1 KS > 10
starke Säuren: pKS < 3,5
schwache Säuren: pKS > 3,5
