Cycloverbindungen
1 Cycloalkane
Ringförmige gesättigte Kohlenwasserstoffe
a) Allgemeine Summenformel
C₂H₂n
b) Eigenschaften
⇨ Ähnliche Eigenschaften wie die Alkane;
Ausnahmen:
| Cyclopropan | Cyclobutan |
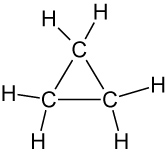 |
 |
⇨ reagieren leicht unter Ringöffnung.
Grund: Ringspannung, da Bindungswinkel auftreten, die erheblich unter dem Idealwert des vierbindigen Kohlenstoffatoms liegen (109,47 bzw. 109,5° ~ Tetraederwinkel).
1.1 Cyclohexan
wichtigstes Cycloalkan; Baustein vieler Naturstoffe
a) Vorkommen
Erdöl
b) Eigenschaften
Ähnelt Hexan (unpolar; radikalische Substitutionsreaktionen sind bevorzugt)
Verschiedene Konformationen des Cyclohexans:
| Sesselkonformation (99%) | Wannen-(Boot-)konformation |
 |
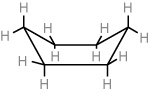 |
H = axial
H = äquatorial (bei größeren Substituenten energetisch günstiger)
Merke: Verschiedene räumliche Anordnungen von Molekülen bezeichnet man als Konformationen. Bei Cyclohexanen ist die Sesselkonformation die stabilste Konformation, da hier alle H-Atome den größtmöglichen Abstand haben.
c) Verwendung
Lösungsmittel; Herstellung von Nylon
- Details
- Geschrieben von: Wolfram Hölzel
2 Aromatische Kohlenwasserstoffe - Aromaten - Arene
“aromatisch” a. G. des süßlichen Geruchs vieler Naturstoffe.
Vorkommen i. d. Natur z.B.
Aminosäuren: Tyrosin, Typtophan, Phenylalanin
Nucleinbase Adenin
Lignin
weibliches Sexualhormon Estradiol (Ausbildung sek. Geschlechtsmerkmale)
2.1 Benzol - “Benzen”
a) Vorkommen
Steinkohlenteer, Erdöl
b) Eigenschaften
physikalische:
- farblose, klare Flüssigkeit (Smp.: 5°C; Sdp.: 80°C)
- geringere Dichte als Wasser
- in Wasser kaum, in Benzin in jedem Verhältnis löslich
- hohe Lichtbrechung
chemische:
- brennt mit stark rußender Flamme
- kein Nachweis von Doppelbindungen mit Brom möglich (Additionsreaktion)
- elektrophile Substitution mit Brom ist möglich
physiologische:
- starkes Gift
- carcinogen
c) Summenformel
C₆H₆
d) Strukturformel
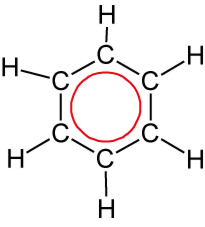
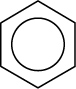
August Kekulé (1866): Oszillationstheorie – schnelles „Umklappen“ der Doppelbindungen (nicht bestätigt).
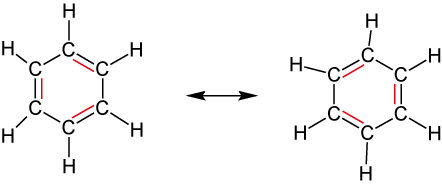
Heutiger Kenntnisstand:
- ebenes gleichseitiges Sechseck
- Bindungsabstände:
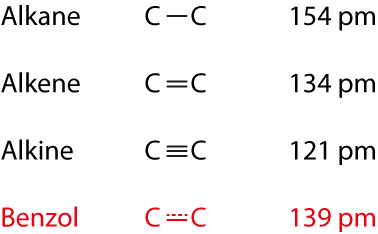
- Bindungswinkel 120°
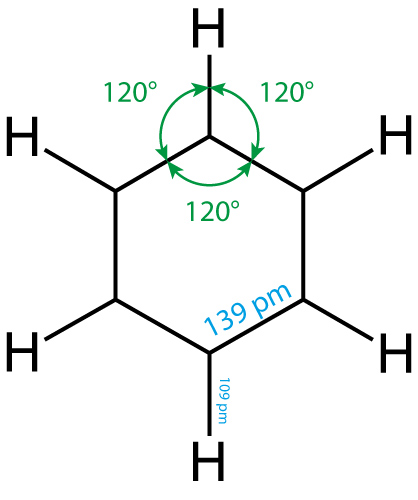
- Die je 6 Elektronen sind gleichmäßig über das ganze Sechseck verteilt = delokalisiert
⇨ Besonderer Bindungszustand!
 |
=  |
Energetischer Vergleich zwischen Benzol mit delokalisierten Elektronen und Kekulés Modell:

e) Vergleich von Cyclischen Kohlenwasserstoffe
⇨ vgl. AB
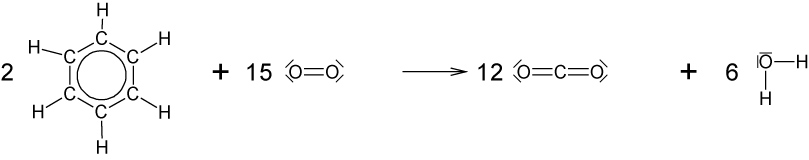
f) vollständige Verbrennung von Benzol
- Details
- Geschrieben von: Wolfram Hölzel
2.2 Hückel-Regel
a) Dewar: cyclische Moleküle mit großer Mesomerieenergie sämtliche Ringatome gehören zu einem konjugierten System (=C-C=C-C=….)
b) Hückel: Aromaten sind besonders stabile Verbindungen, mit folgenden Eigenschaften:
- Moleküle bestehen aus ebene Ringe;
- besitzen ringförmig geschlossenen π-Elektronenwolke;
- insgesamt (4n + 2) π-Elektronen (n = 0,1,2,3...) (delokalisiert über alle Ringatome des Systems).
- Besonders stabil bei ungeraden Elektronenpaaren
| n | 0 | 1 | 2 | 3 | 4 |
|
π-Elektronen |
2 | 6 | 10 | 14 | 18 |
|
π-Elektronenpaare |
1 | 3 | 5 | 7 | 9 |
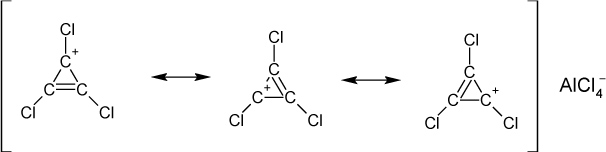
Beispiel 1: 1,2,3-Trichlor-Cyclopropene
n = 0: (4 ∙ 0 + 2) = 2 π – Elektronen:
Überprüfe die Hückel-Regel an Hand von Benzol:
6 Ringatome = 4 • 1 + 2 ⇨ Regel ist erfüllt.
Weitere Übungsaufgaben ⇨ siehe Arbeitsblatt.
- Details
- Geschrieben von: Wolfram Hölzel
2.3 Nomenklatur:
Stammverbindung: Benzol – C₆H₆
Benzolring als Substituent: Phenyl = Benzolrest
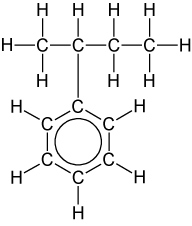
Bsp.: 2-Phenylbutan CH₃CH(C₆H₅)CH₂CH₃
Allg aromatische Kohlenwasserstoffgruppe: Arylgruppe
Kondensierte Formen:
| Napthalin | Anthracen |
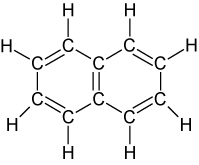 |
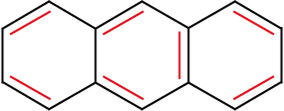 |
Systematische Nomenklatur: Nummerierung der C-Atome von 1-6 ⇨ Richtung wird so gewählt, dass die Substituenten die kleineren Zahlen erhalten. Hinweis: Substituenten werden alphabetisch geordnet.
Beispiel:

1-Ethyl-3-Methylbenzol
Dimethylbenzole (= Xylole)
Afg.: Zeichne alle Möglichkeiten und benenne diese.
Lösung:

veraltet Benennung: ortho/meta/para
- ortho- [o-] = 2
- meta- [m-] = 3
- para- [p-] = 4
Afg. Benenne folgende Bindung:
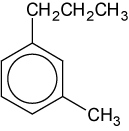
[Lösung (markieren zum Sehen): 1-Methyl-3-propylbenzol]
- Details
- Geschrieben von: Wolfram Hölzel
2.4 Heteroaromaten
Heteroaromaten: Kohlenstoffatom ist im Ring „ersetzt“ durch anderes Atom (Bsp. : Stickstoff-, Sauerstoff-, Schwefelatom). Hückel-Regel muss erfüllt sein.
Ein freies Elektronenpaar des Heteroatoms kann am delokalisierten Ringelektronensystem beteiligt sein.
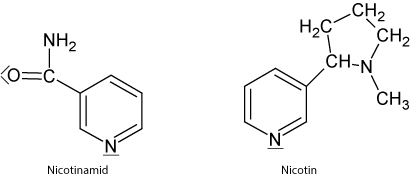
2.4.1 Pyridin
Elektronenpaar des Stickstoffatoms zeigt nach außen.
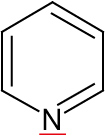
Pyridin-Derivate sind häufig in Naturstoffen (Nicotinamid (= Vitamin B3); NADP⁺)
2.4.2 Pyrrol
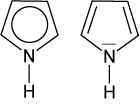
Freies e--Paar ist am Ringsystem beteiligt.
Pyrrol-Ringe finden sich z.B. in Porphyrine (Porphin, Häm und Chlorophyll, das Vitamin B12) und die Gallenfarbstoffe (Bilirubin, Urobilin)
2.4.3 Furan
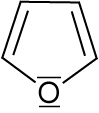
Ein freies e--Paar ist am Ringsystem beteiligt.
- Details
- Geschrieben von: Wolfram Hölzel
