2. Die Chemische Reaktion
2.1 Eisen reagiert mit Schwefel
2.2 Chemische Reaktion und Energie
2.3 Kupfer reagiert mit Schwefel
2.4 Zink reagiert mit Schwefel
2.5 Silber reagiert mit Schwefel
2.6 Zusammenfassung (Herstellung von Metallsulfiden)
2.7 Rückgewinnung von Metallen aus Metallsulfiden
2.8 Aktivierungsenergie
- Details
- Geschrieben von: Wolfram Hölzel
2. Die chemische Reaktion
2.1 Eisen reagiert mit Schwefel
a) Aufbau
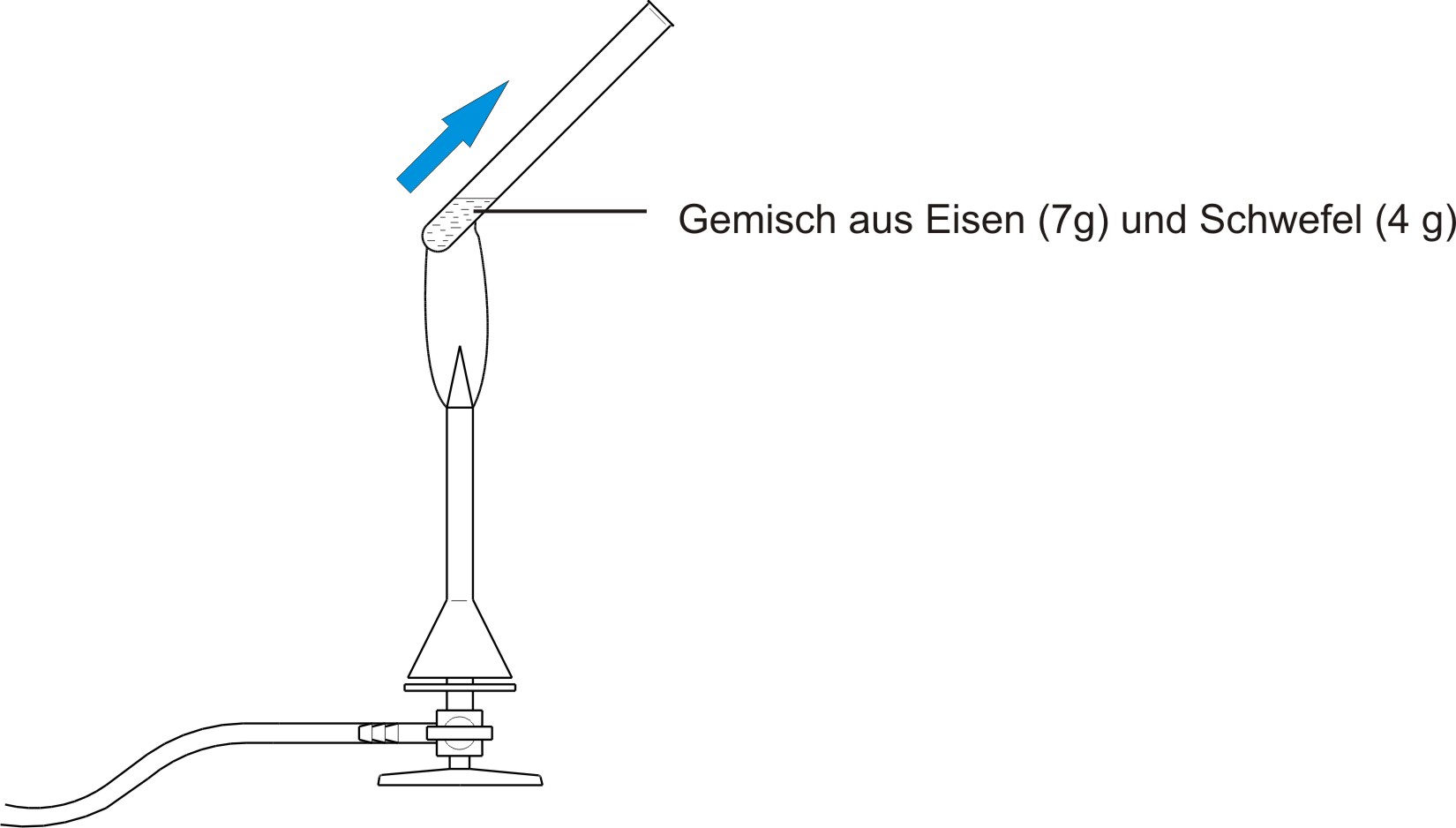
Beobachtung
Eisen- und Schwefelpulver reagieren beim Erhitzen unter Aufglühen zu einem braun-schwarzen Feststoff (Eisensulfid).
b) Eigenschaften
| Eisen | Schwefel | Eisensulfid | |
| Farbe | grau | gelb | braun-schwarz |
| Festigkeit | zäh | spröde | spröde |
| Magnetismus | + | - | - |
| Schmelztemperatur | ca. 1500 °C | 113 °C | ca. 1200 °C |
| Dichte [g/cm³] | ca. 7,9 | 2 | 4,8 |
| Stoffklasse |
metallische |
flüchtige Stoffklasse |
salzartige Stoffklasse |
c) Reaktionsschema (Reaktionsgleichung)

Merke:
Vorgänge, bei denen sich Stoffe in andere Stoffe umwandeln, nennt man chemische Vorgänge (chemische Reaktionen). Die neu entstandenen Stoffe besitzen andere Eigenschaften als die Ausgangsstoffe.
- Details
- Geschrieben von: Wolfram Hölzel
2.2 Chemische Reaktion und Energie
a) Versuch

Bei dieser Reaktion gibt das reagierende System Energie ab: exotherme Reaktion
Erklärung
Das System (Gemisch der Ausgangsstoffe Eisen + Schwefel) hat einen bestimmten Energieinhalt (Enthalpie). Das Reaktionsprodukt (Eisensulfid) hat ebenfalls einen bestimmten Energieinhalt (Enthalpie), dieser ist jedoch kleiner als der des Ausgangsgemisches.
Die Energie wird nach außen abgegeben.
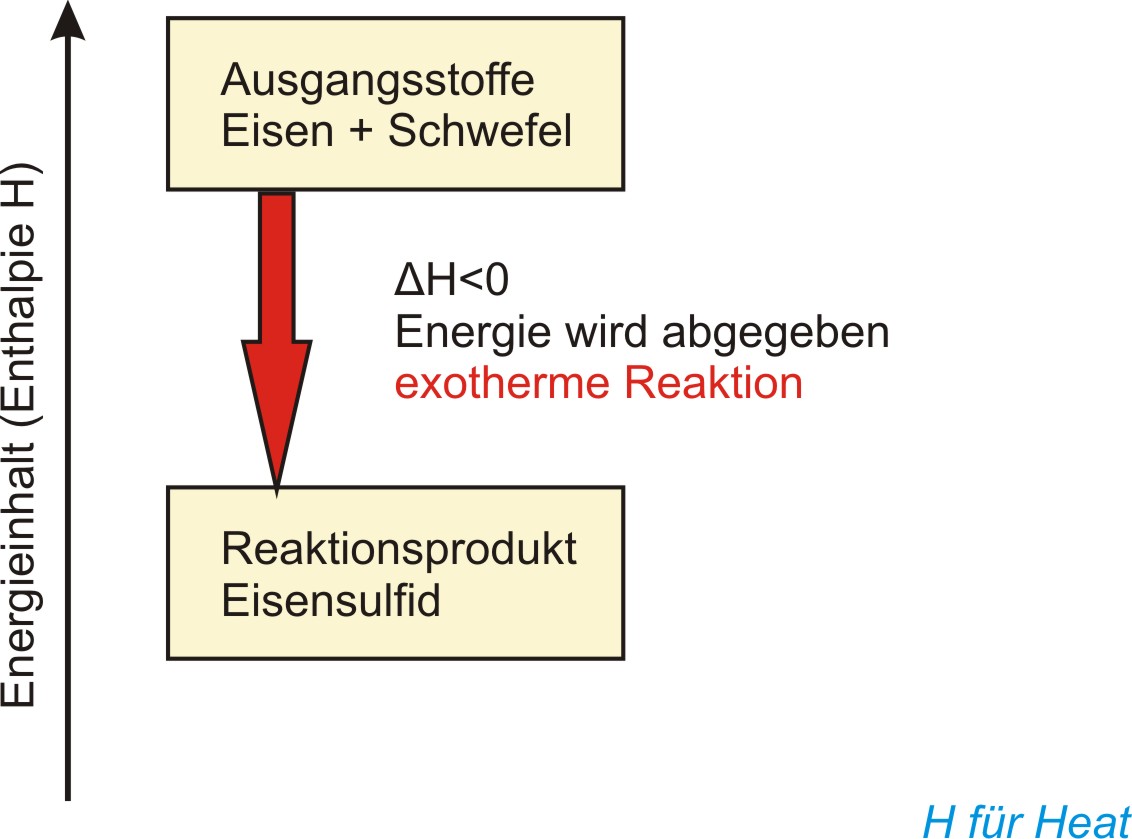
b ) Energiediagramm
(Enthalpiediagramm) für die chemische Reaktion Eisen + Schwefel
Die Enthalpie ist der Energieinhalt eines Stoffsystems. Man kann nur Enthalpiedifferenzen (ΔH) messen.
Berechnung für die Enthalpieänderung:
ΔH = H(Endprodukte) - H(Ausgangsstoffe)
Exotherme Reaktionen verlaufen unter Energieabgabe (ΔH < 0);
endotherme Reaktionen verlaufen unter Energieaufnahme (ΔH > 0).
c) Merke:
Chemische Reaktionen sind Vorgänge, bei denen Stoffe mit neuen Eigenschaften gebildet werden. Dabei wird Energie aufgenommen oder abgegeben.
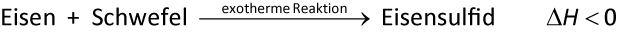
- Details
- Geschrieben von: Wolfram Hölzel
2.3 Kupfer reagiert mit Schwefel
a) Versuch

Kupferblech und Schwefel reagieren beim Erhitzen unter schwachem Aufglühen zu einem spröden schwarzblauen
Feststoff.
b) Reaktionsschema (Reaktionsgleichung)
Kupfer + Schwefel → Kupfersulfid ΔH < 0
rötlich gelb blauschwarz
Ausgangsstoffe (vorher) Reaktionsprodukt (nachher)
2.4 Zink reagiert mit Schwefel
a) Versuch

b) Beobachtung
Das Gemisch aus Zink und Schwefel reagiert beim Zünden sehr heftig. Es entsteht ein weißer Feststoff.
c) Reaktionsschema (Reaktionsgleichung)
Zink + Schwefel → Zinksulfid ΔH < 0
grau gelb weiß
2.5 Silber reagiert mit Schwefel
a) Versuch
Etwas Schwefelpulver wird auf einem Silberblech vorsichtig erhitzt.
b) Beobachtung
Es entsteht ein schwarzer Feststoff.
c) Reaktionsschema
Silber + Schwefel → Silbersulfid ΔH < 0
silbrig gelb schwarz
2.6 Zusammenfassung (Herstellung von Metallsulfiden)
Die Metalle Zink, Eisen, Kupfer und Silber reagieren mit Schwefel in exothermer Reaktion.
Heftigkeitsreihe (Zink reagiert am heftigsten, danach Eisen, Kupfer und schließlich Silber):
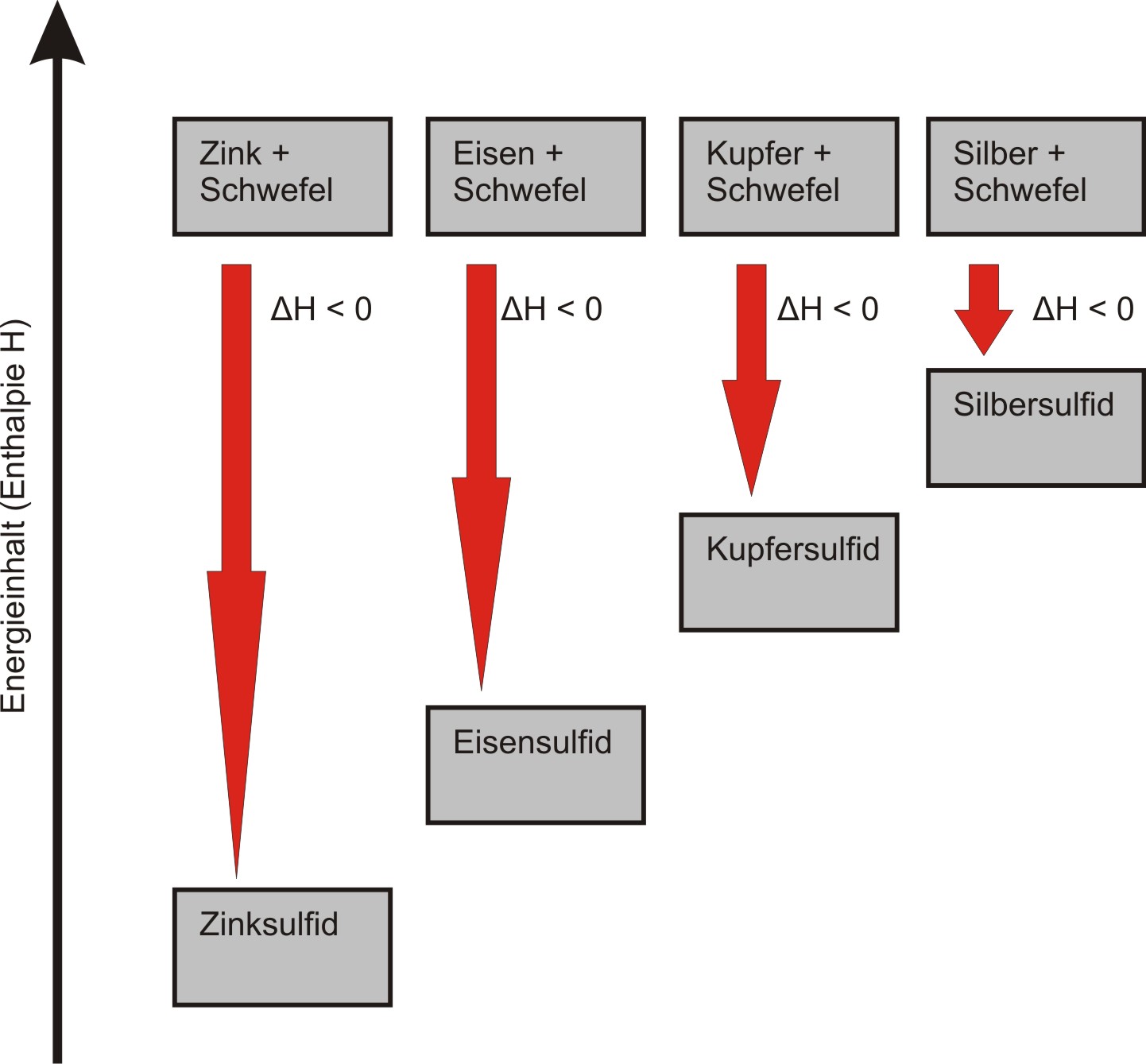
Zink (Zn) > Eisen (Fe) > Kupfer (Cu) > Silber (Ag)
Merke:
Bei exothermen chemischen Reaktionen ist der Energieinhalt der Ausgangsstoffe größer als der der Produkte.
img src=p
- Details
- Geschrieben von: Wolfram Hölzel
2.7 Rückgewinnung von Metallen aus Metallsulfiden
a) Versuch
Silbersulfid wird vorsichtig in der Flamme erhitzt.
b) Beobachtung
Der schwarze Fleck verschwindet; es bildet sich Silber zurück.
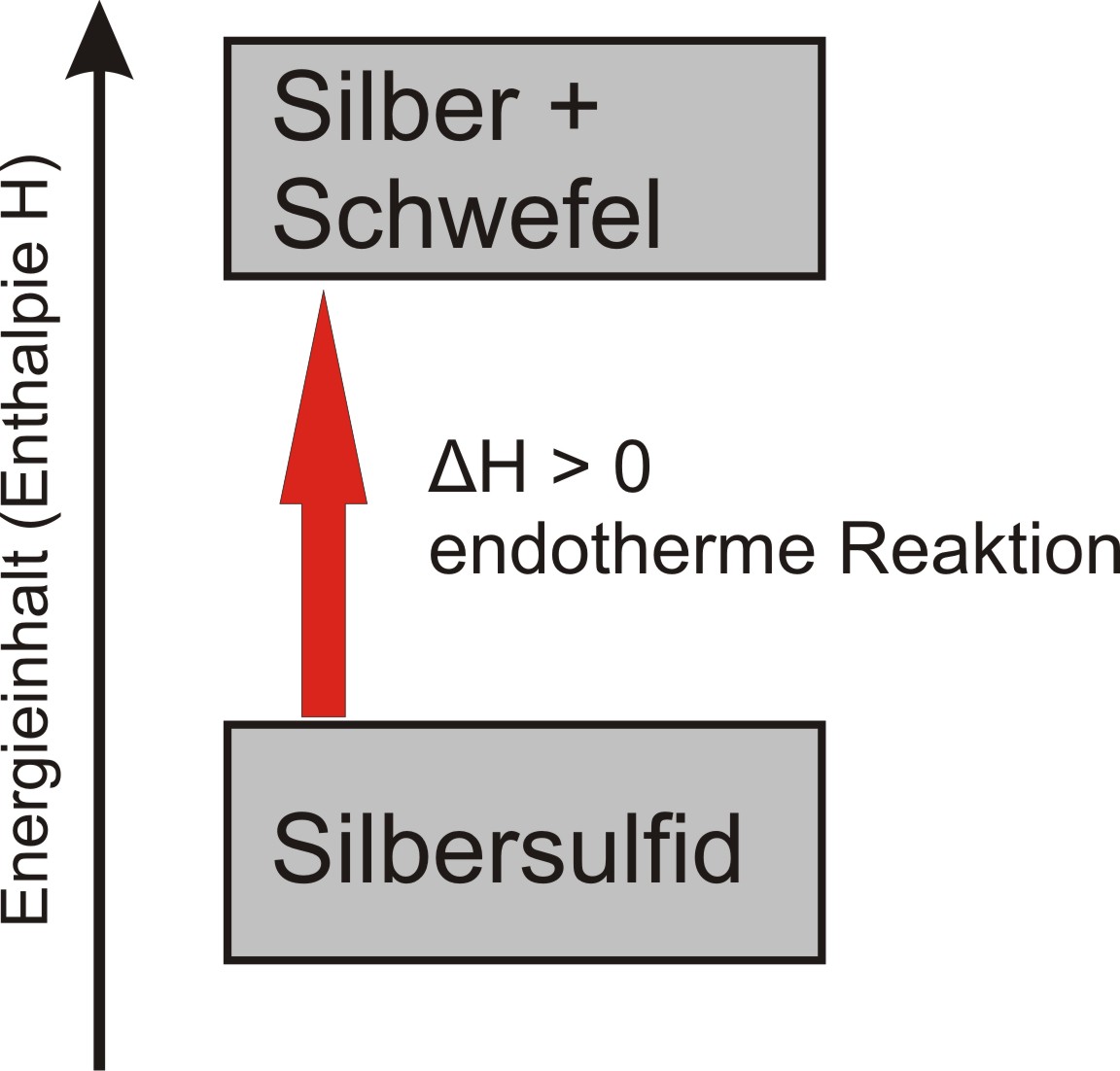
c) Auswertung mit Reaktionsschema
Die Zerlegung des schwarzen Silbersulfids ist eine endotherme chemische Reaktion. Der Schwefel verbrennt anschließend an der Luft.
Silbersulfid → Silber + Schwefel ΔH > 0 (endotherme Reaktion)
d) Enthalpiediagramm für die Silbersulfidzerlegung
- Details
- Geschrieben von: Wolfram Hölzel
