12 Gibbs1 Energie („freie Enthalpie“) – G
Zur Folie aus dem Unterricht:
Gesamtenergie = nutzbare Energie + nicht nutzbare Energie
Enthalpie (H) = freie Energie (G) + Entropie (S) • absolute Temp (T)
Die Gibbs-Energie ist definiert durch:
G = U + p ∙ V – T ∙ S = H – T ∙ S
G = H – T • S ⇨ Da wir die absoluten Größen von G, H und S nicht messen können ⇨ Messung der Änderungen:
Gibbs-Helmholz-Gleichung:
![]()
Zwei Größen (Enthalpie- und Entropieänderung) haben Einfluss auf den Ablauf einer Reaktion in einem geschlossenen System:
ΔG: Änderung der Gibbs Energie (freien Enthalpie) ist die entscheidende Größe, ob eine Reaktion ablaufen kann [kJ]
ΔH: Änderung der Reaktionsenthalpie [kJ]
ΔS: Änderung der Reaktionsentropie [kJ/K]
T: Reaktionstemperatur [K]
Exergonische Reaktionen ΔG < 0
Endergonische Reaktionen ΔG > 0
Merke:
Die Reaktion läuft freiwillig ab, wenn die Änderung der freien Enthalpie ΔG negativ ist. Die freie Enthalpie ist ein Maß für die Triebkraft chemischer Reaktionen.
Die Gibbs-Helmholtz-Gleichung zeigt, dass es für das Zustandekommen einer chemischen Reaktion grundsätzlich 3 Möglichkeiten gibt:
1. ΔG negativ, wenn ΔH negativ und ΔS positiv
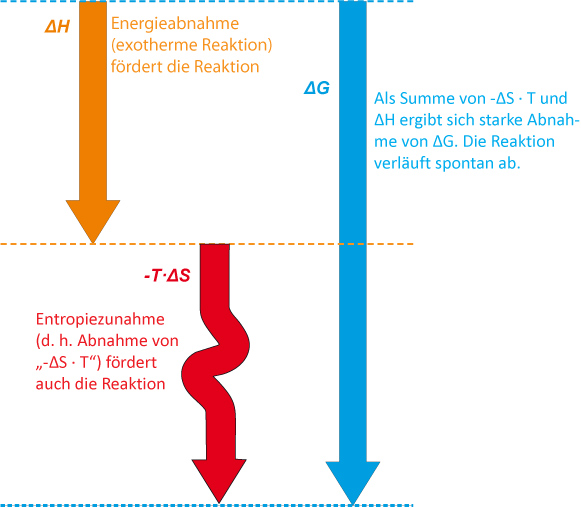
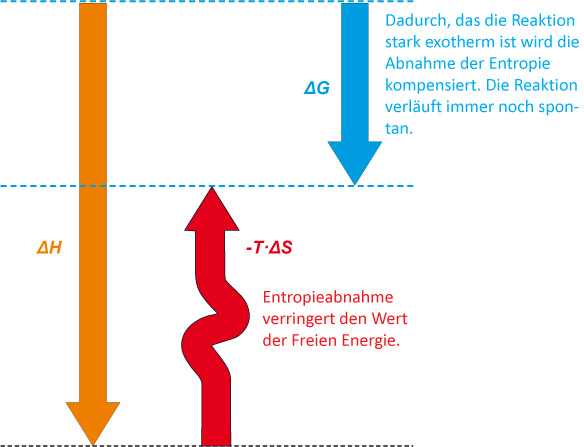
2. ΔH negativ und ΔS negativ; die Reaktion ist exergonisch, wenn das Enthalpieglied einen größeren Wert als das Entropieglied besitzt.
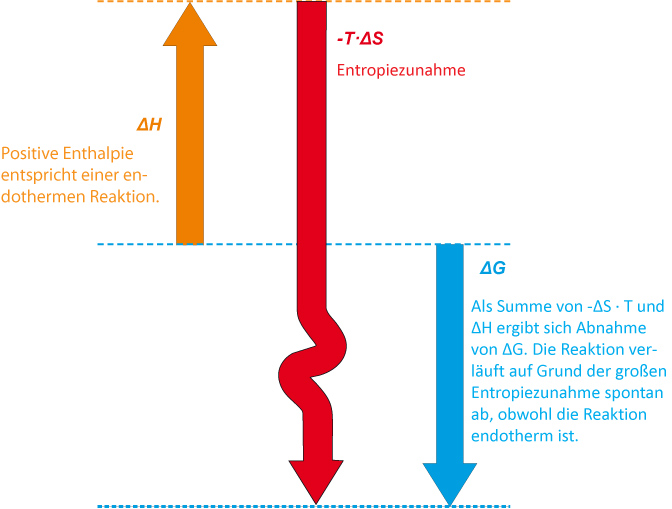
3. ΔH positiv und ΔS positiv; die Reaktion ist exergonisch, wenn das Entropieglied einen größeren Wert als das Enthalpieglied bekommt.
| Reaktion |
Reaktionsenthalpie |
Reaktionsentropie |
Geltungsbereich | Freie Enthalpie ΔG |
| Exotherm | < 0 < 0 < 0 |
> 0 < 0 < 0 |
Immer T klein T groß, |T∙ΔS|> |ΔH| |
- exergonisch - exergonisch + endergonisch |
| Endotherm | > 0 > 0 > 0 |
< 0 > 0 > 0 |
Immer T groß T klein, |T∙ΔS|> |ΔH| |
+ endergonisch - exergonisch + endergonisch |
¹ Josiah Willard Gibbs (* 11. Februar 1839 in New Haven, Connecticut; † 28. April 1903 ebenda) war ein US-amerikanischer Physiker.
